Série d'exercices : Niveaux d'énergie de l'atome - Ts
Classe:
Terminale
Exercice 1
Les énergies des différents niveaux, exprimés en électron-volt, sont données par la formule :
$E_{n}=\dfrac{-13.6}{n^{2}}$
1) Calculer les énergies correspondant à $n=1\;,\ 2\;,\ 3$ et $\infty$ et représenter le diagramme des niveaux d'énergie de l'atome d'hydrogène.
2) Quelle est l'énergie minimale que l'on doit fournir à un atome d'hydrogène pour qu'il passe de l'état fondamental à un état excité ?
La transcrire sur le diagramme.
3) Cette énergie est apportée à l'atome par une radiation lumineuse monochromatique.
Calculer sa longueur d'onde.
4) Calculer la longueur d'onde de la radiation susceptible d'ioniser l'atome d'hydrogène
Exercice 2
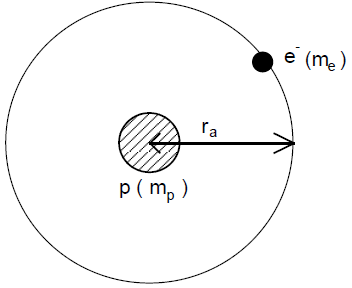
1) Rutherford a décrit l'atome d'hydrogène par le modèle planétaire :
l'électron a un mouvement circulaire, de rayon $r$, autour d'un noyau constitué de proton.
La force électrique subie l'électron est dirigée selon la droite proton-électron, attractive de valeur $F=\dfrac{ke^{2}}{r^{2}}$
La force gravitationnelle est négligeable devant cette force
a) Montrer que le mouvement de l'électron est uniforme
b) Établir l'expression de la vitesse $v$ en fonction de $k$, $e$, $r$ et $m$
c) Exprimer son énergie cinétique en fonction de ces mêmes paramètres.
d) Exprimer en énergie mécanique $E$ en fonction de $k$, $e$ et $r$ sachant que son énergie potentielle est : $E_{p}=-\dfrac{ke^{2}}{r}$
Quelle est sa limite quand $r$ tend vers l'infini
2) Différents faits expérimentaux ont conduit Niels Bohr à formuler l'hypothèse suivante :
l'électron ne se déplacer que sur certains cercles dont les rayons $r_{n}$ obéissent à la loi :
$v_{n}r_{n}=\dfrac{nK}{m}$ ; $K$ constante universelle :
$K=1.054\cdot10^{-34}J\cdot s$
$n$ : nombre entier $n\geq 1$ ;
$v_{n}$ vitesse de l'électron sur le cercle de rayon $r_{n}$
a) Déterminer l'expression de $r_{n}$ en fonction des constantes $k$, $K$, $m$, $e$ et $n.$
Exprimer $r_{n}$ en fonction de $r_{1}.$
Calculer $r_{1}$
b) Déterminer l'expression de $E_{n}$, énergie mécanique de l'électron sur le cercle de rayon $r_{n}$, en fonction des mêmes paramètres
Exprimer $E_{n}$ en fonction de $E_{1}$
c) Calculer $E_{1}$ et $E_{2}$ en électronvolts.
Quelle cause peut faire passer l'énergie de l'électron de $E_{1}$ à $E_{2}.$
$m_{e}=9.109\cdot10^{-31}Kg$ ;
$e=1.602\cdot10^{-19}$ ;
$k=9.000\cdot10^{9}SI$
Exercice 3 L'atome d'hydrogène
Diagramme d'énergie de l'atome d'hydrogène obtenu à partir de la formule : $E_{n}=-\dfrac{13.6}{n^{2}}(en\ eV)$
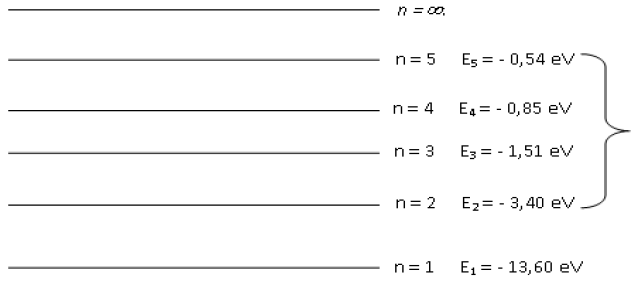
1) Quel est le nom du nombre noté $"n"$ qui apparaît dans le diagramme ?
2) Quant dit-on qu'un atome est dans son état fondamental ?
Quel est l'état fondamental de l'atome d'hydrogène ?
Le noter sur schéma.
3) Considérons une population d'atomes d'hydrogène au repos, sans apport d'énergie de la part extérieur.
Dans quel état se trouvent les atomes (ou du moins l'immense majorité) ?
4) Que représente le niveau noté : $n=\infty$ ?
Noter son nom sur le schéma.
5) Quelle énergie minimale, en $eV$, faut-il fournir à un atome d'hydrogène pour l'ioniser lorsqu'il est dans son état fondamental ?
6) Un atome d'hydrogène à la configuration électronique telle que : $n=3$
$\bullet\ $ Est-il dans son état fondamental ?
Comment s'appelle un tel état?
$\bullet\ $ Le représenter par un petit point sur le diagramme précédent
7) L'atome d'hydrogène peut-il se trouver dans un état situé entre les niveau $n=1$ et $n=2$ ?
8) L'atome d'hydrogène est excité sur le niveau : $n=3$
$\bullet\ $ Comment peut-on exciter cet atome ?
$\bullet\ $ Montrons qu'en se dés-excitant vers le niveau $2$, il émet un photon de longueur d'onde : $\lambda=656.1\,nm.$
Cette radiation est-elle située dans les $X$, les $UV$, le visible ou $l'IR$ ?
$\bullet\ $ Représenter par un flèche, sur le diagramme précédent, la transition correspondant à cette dés excitation.
9) Une radiation émise par l'atome d'hydrogène a une égale à : $E+2.54eV$
$\bullet\ $ cette radiation émise par l'atome d'hydrogène fait partie de la série de balmer $($retour au niveau $n=2.)$
Déterminer la transition électronique correspondant à l'émission de cette radiation.
La noter sur le schéma.
$\bullet\ $ Calculer la longueur d'onde correspondante.
10) Une lampe à décharge à hydrogène émet-elle un spectre continu de radiation ou un spectre discontinu ?
Exercice 4
Données :
célérité de la lumière dans le vide : $3\cdot10^{8}m/s$ ;
constante de Planck : $h=6.62\cdot10^{-34}\,js$ ;
charge élémentaire : $e=1.6\cdot10^{-19}C$ ;
masse de l'électron $m=9\cdot10^{-31}\,Kg.$
La figure représente un diagramme très simplifié des niveaux d'énergie de l'atome de lithium de numéro atomique $Z=3$, de formule électronique $K^{2}L^{1}.$
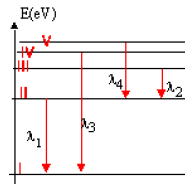
On considère les quatre transitions représentées sur le diagramme.
Les longueurs d'ondes correspondantes sont :
$\lambda1_{1}=671\,nm$ ;
$\lambda_{2}=812\,nm$ ;
$\lambda_{3}=323\,nm$ et
$\lambda_{4}=610\,nm.$
1) Expliquer brièvement niveau d'énergie et spectres de raies.
2) Montrer qu'entre l'énergie $E(en\ eV)$ d'un photon et sa longueur d'onde $\lambda$ il existe la relation $E=\dfrac{1240}{\lambda}.$
$\lambda$ étant exprimé en $nm$ et $E$ en $eV.$
$-\ $ Déterminer l'énergie $(eV)$ des photons émis lors de chacune des $4$ transitions.
3) L'énergie du niveau $I$ vaut $E_{1}=-5.39\,eV.$
C'est l'énergie de l'électron externe dans son état fondamental.
Affecter l'énergie $E_{i}(eV)$ à chaque niveau du diagramme.
Pour quelle valeur de la longueur d'onde des radiations incidentes les atomes de lithium subiront-ils une ionisation à partir de l'état fondamental ?
Exercice 5 : Niveaux d'énergie de l'atome d'hydrogène
On s'intéresse dans ce qui suit aux niveaux d'énergie des atomes d'hydrogène et de sodium, tous deux éléments de la première colonne du tableau de classification périodique.
1. Les niveaux d'énergie de l'atome d'hydrogène sont donnés par la relation : $E_{n}=-\dfrac{13.6}{n^{2}}$ où $E_{n}$ en $eV$ et $n$ un entier naturel non nul.
1.1 Déterminer l'énergie minimale en $eV$, qu'il faut fournir à l'atome d'hydrogène pour l'ioniser dans les cas suivants :
1.1.1 L'atome d'hydrogène est initialement à son état fondamental $(n=1)$
1.1.2 L'atome d'hydrogène est à l'état excité correspondant au niveau d'énergie $(n=2).$
1.2 Faire le schéma du diagramme des niveaux d'énergie de l'atome d'hydrogène en utilisant l'échelle :
$1\,cm$ pour $1eV.$
On ne représentera que les six premiers niveaux.
2. On donne ci-dessous le diagramme simplifié des niveaux d'énergie de l'a tome de sodium (l'échelle n'est pas respectée).
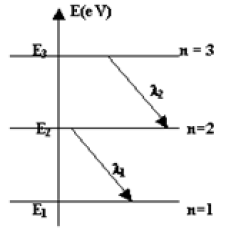
L'état fondamental correspond au niveau d'énergie $E_{1}.$
Les niveaux d'énergie $E_{2}$ et $E_{3}$ correspondant à des états excités.
2.1 Lorsque l'atome passe de $E_{2}$ à $E_{1}$ il émet une radiation de longueur d'onde $\lambda_{1}=589\,nm$ ; lorsqu'il passe de $E_{3}$ à $E_{2}$, il émet une radiation de longueur d'onde $\lambda=568.8nm.$
En expliquant le raisonnement, calculer la différence d'énergie $(E_{3}-E_{1})$ en $eV.$
2.2 Lorsque l'atome, initialement dans son état fondamental, est éclairé par un faisceau monochromatique de longueur d'onde $\lambda$ convenable, il peut directement passer du niveau d'énergie $E_{1}$ au niveau d'énergie $E_{3}.$
Exprimer la longueur d'onde $\lambda$ de ce faisceau en fonction des longueurs d'onde $\lambda_{1}$ et $\lambda_{2}.$
Faire l'application numérique
Exercice 6
La mécanique quantique montre que l'état fondamental de l'atome d'hydrogène est caractérisé par une énergie $E_{1}=-13.6ev$ et chaque niveau excité $n>1$ est définie par une énergie $E_{n}=-\dfrac{E_{0}}{n^{2}}$ $(n$ est un entier naturel positif$)$ avec $E_{0}=13.6ev.$
1) A quoi correspond l'énergie $E_{0}$ ?
2) Quelle relation simple existe entre l'énergie de transition $\Delta\,E$ d'un niveau $n$ à un niveau $p$ et la longueur d'onde du photon émis ou absorbé.
(Traiter chaque cas à part)
3) a) Montrer que pour une transition d'un niveau $p$ à un niveau $n$ tel que $p>n$, on peut écrire la relation $\dfrac{1}{\lambda}=R_{H}\left(\dfrac{1}{n^{2}}-\dfrac{1}{p^{2}}\right).$
b) Vérifier que $R_{H}$ (appelée constante de Rydberg) vaut $R_{H}=1.10\cdot10^{+7}\,m^{-1}$
c) Dans la série de Balmer $($le retour au niveau $n=2)$ l'atome $H$ émet $1$ spectre contenant $4$ raies visibles, on se propose de calculer deux longueurs d'ondes de $2$ raies de ce spectre correspondant à $p=3(\lambda_{3.2})$ et $p=4(\lambda_{4.2}).$
Sans faire de calcul, et en utilisant $\Delta\,E$, comparer $\lambda_{3.2}$ et $\lambda_{4.2}$ puis calculer leurs valeurs.
4) L'atome $H$ est dans son état fondamental $(n=1)$, on l'excite à l'aide d'un photon incident d'énergie $W=130.8\,ev.$
Que se passe-t-il ?
Calculer $(en\ ev)$ l'énergie cinétique $E_{c}$ de l'électron de $H$ éjecté.
5) si l'atome entre en choc inélastique avec un électron ayant une énergie cinétique égale $11ev$, que se passe-t-il ?
Exercice 7
Données :
charge élémentaire : $e=1.6\cdot10^{-19}C$
Constante de Planck : $h=6.62\cdot10^{-34}J\cdot s$
célérité de la lumière dans le vide : $c=3\cdot10^{8}m\cdot s^{-1}$
$1eV=1.6\cdot10^{-19}J$
$1nm=10^{-9}m$
Le spectre de l'atome d'hydrogène est obtenu par décharge électrique dans un tube contenant du dihydrogène sous faible pression.
Deux électrodes situées à chaque extrémité du tube permettent d'appliquer une différence de potentiel.
Lorsque les paramètres (d.d.p, température, pression) sont correctement fixés, on observe l'émission de lumière dont l'analyse est faite à l'aide d'un spectroscope.
Le spectre obtenu est constitué, dans sa partie visible, de quatre raies notées $H_{\alpha}$ $H_{\beta}$ $H_{\lambda}$ $H_{\delta}$ de longueurs d'onde respectives dans le vide :
$656.27\,nm$ ;
$486.13\,nm$ ;
$434,05\,nm$ ;
$410.17\,nm.$
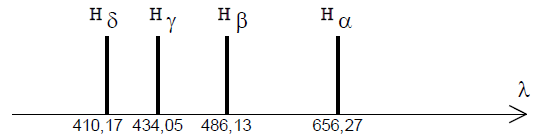
Spectre d'émission de l'atome d'hydrogène
1. Sachant que les couleurs des raies émises sont bleue, indigo, rouge et violette, restituer à chaque radiation sa couleur.
2. En 1885, le physicien suisse Balmer, remarque que les longueurs d'onde $\lambda$ de ces quatre radiations satisfont à une relation empirique :
$$\lambda=\lambda_{0}\dfrac{n^{2}}{n^{2}-4}$$
$\lambda_{0}=367.7nm$, $n$ est un nombre entier naturel non nul $(n\in\mathbb{N^{\ast}})$
2.1 Indiquer la plus petite valeur possible de $n.$
En déduire la longueur d'onde de la raie correspondante.
2.2 Quelles valeurs doit prendre $n$ pour retrouver les autres raies visibles du spectre ?
3. Les niveaux d'énergie quantifiés de l'atome d'hydrogène sont donnés par la relation :
$E_{n}=-\dfrac{E_{0}}{n^{2}}(eV)\quad\left\lbrace\begin{array}{lcl} E_{0}&=&13.6\,eV\\ n&\text{est}&\text{un nombre entier naturel non nul.} \end{array}\right.$
Pour $n=1$ l'énergie de l'atome est minimale, l'atome est dans son état fondamental.
Pour toutes les autres valeurs de $n(n\geq 2)$, l'atome est dans un état excité.
3.1 Expliquer brièvement le terme “ niveau d'énergie quantifié ”.
Que représente $E_{0}$ pour l'atome d'hydrogène ?
3.2 Établir, en fonction de $n$, la fréquence $v_{n\;,\ 2}$ $($exprimée en $Hz)$ des radiations émises lorsque cet atome passe d'un état excité $n>2$ à l'état excité $n=2.$
3.3 Retrouver l'expression empirique de Balmer :
$$\lambda=\lambda_{0}\dfrac{n^{2}}{n^{2}-4}$$
$\lambda$ étant exprimée en $nm.$
A quelle transition correspond l'émission de la radiation de longueur d'onde $\lambda_{0}$ ?
Justifier la réponse.
3.4 Tracer le diagramme représentant les transitions entre les différents niveaux d'énergie de l'atome d'hydrogène pour les quatre raies $H_{\alpha}$, $H_{\beta}$, $H_{\lambda}$, $H_{\delta}$ de la série de Balmer.
4.1 Quelle est l'énergie cinétique minimale d'un électron projectile capable de provoquer par choc l'excitation d'un atome d'hydrogène de son état fondamental à son deuxième état excité ?
4.2 Sous quelle tension minimale cet électron projectile, initialement au repos, a-t-il été accéléré ?
4.3 L'atome d'hydrogène précédemment excité revient à son état fondamental avec émission de deux photons.
Déterminer les longueurs d'onde de ces deux photons.
Exercice 8
Données :
$h=6.62\times10^{-34}J\cdot s$ ;
$c=3.00\times10^{8}m\cdot s^{-1}$
et $e=1.60\times10^{-19}C$
Les lampes à vapeur de lithium contiennent de la vapeur de lithium à très faible pression.
Cette vapeur est excitée par un faisceau d'électrons qui traverse le tube.
Les atomes de lithium absorbent l'énergie des électrons.
L'énergie est restituée lors du retour à l'état fondamental sous forme de radiations lumineuses.
On représente le diagramme des niveaux d'énergie de l'atome de lithium (figure 1) de numéro atomique $Z=3.$
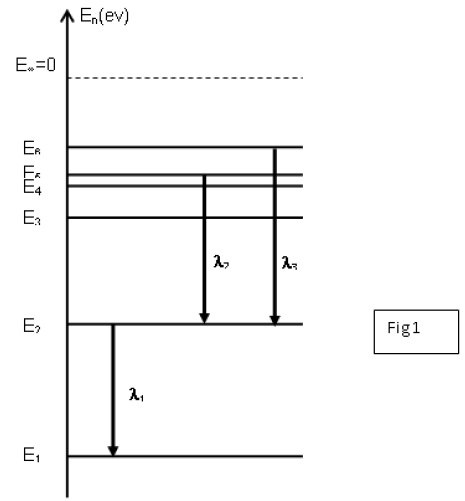
L'analyse du spectre d'émission d'une lampe à vapeur de lithium révèle la présence de raies de longueur d'onde $\lambda$ bien définie.
On donne le spectre d'émission et le spectre d'absorption de l'atome de lithium (figure 2).
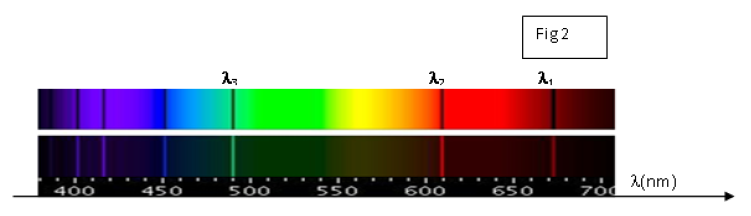
1) Préciser le spectre d'émission de l'atome de lithium et le spectre d'absorption.
2) Représenter le schéma du montage qui permet d'obtenir le spectre d'émission.
3) A l'aide du spectre d'émission, interpréter la quantification de l'énergie de l'atome de lithium.
4) L'énergie du l'état fondamental vaut $E_{1}=-5.39eV.$
(C'est l'énergie de l'électron de la couche externe dans son état fondamental).
a) Prélever les valeurs des longueurs d'onde $\lambda_{1}$ ; $\lambda_{2}$ et $\lambda_{3}$
b) Montrer que la longueur d'onde $\lambda$ du photon émis lors d'une transition du niveau $n$ au niveau $p(n>p)$ est $\lambda=\dfrac{1241}{E_{n}-E_{p}}$ avec $\lambda$ en $nm$ et $E_{n}-E_{p}$ en $ev.$
c) trouver les valeurs d'énergie des autres niveaux sachant que la longueur d'onde du photon émis lors d'une transition du niveau :
$\bullet\ \ 3$ au niveau est égale à $812nm.$
$\bullet\ \ 4$ au niveau est égale à $323nm.$
5) définir l'énergie d'ionisation de l'atome de lithium.
Donner sa valeur.
6) L'atome de sodium, considéré maintenant à l'état fondamental, reçoit une radiation lumineuse dont le quantum d'énergie a une longueur d'onde $\lambda$ égale à :
a) $220nm.$
b) $300nm$
Exercice 9
Dans le spectre d'émission de l'atome d'hydrogène on trouve les quatre raies suivantes, caractérisées par leur longueur d'onde :
$\lambda_{1}=410\,nm$ (violet),
$\lambda_{2}=434.1\,nm$ (indigo),
$\lambda_{3}=486.1\,nm$ (bleu) et
$\lambda_{4}=656.3\,nm$ (rouge).
On donne le diagramme des niveaux d'énergie de l'atome d'hydrogène.
1) Justifier la discontinuité du spectre d'émission.
a) Que signifie l'état fondamental de l'atome ?
b) Définir l'énergie d'ionisation de l'atome d'hydrogène.
Donner sa valeur.
2) a) Calculer la longueur d'onde maximale $\lambda_{max}$ correspondant à la transition de l'électron d'un niveau $n>2$ au niveau $2.$
Déduire que $\lambda_{max}=\lambda_{4}.$
b) A quelle transition correspond chacune des radiations de longueur d'onde $\lambda_{1}$, $\lambda_{2}$ et $\lambda_{3}.$
3) a) L'atome d'hydrogène est dans son niveau d'énergie $E_{2}\ (n=2)$, reçoit un photon incident de longueur d'onde $\lambda=486.1\,nm.$
Ce photon est-il absorbé ?
justifier sans calcul.
b) L'atome d'hydrogène est dans son état fondamental, reçoit :
$\bullet\ $ Un photon d'énergie $11\,ev.$
$\bullet\ $ Un électron incident d'énergie cinétique $11\,ev.$
$\bullet\ $ Un photon d'énergie $14.3\,ev.$
Dire, en le justifiant ce qui se passe dans chaque cas (dans le cas où l'atome est ionisé donner l'énergie cinétique de l'électron émis).
Exercice 10 Étoile Vega et son spectre
L'étoile Véga se trouve dans la constellation de la Lyre.
Elle émet de la lumière que l'on peut décomposer.
On obtient un spectre dont voici sa représentation :
La première raie à $x=0\,cm$ correspond à la longueur d'onde $\lambda=400\,nm$ et la dernière raie correspondant à $x=8.5\,cm$ est la longueur d'onde $\lambda=700\,nm.$
A chaque raie correspond une abscisse $x$ sur l'axe orienté.
La longueur d'onde $\lambda$ est fonction affine de $x$ de la forme $\lambda=ax+b.$
1) Quelle est la nature du spectre ?
2) En déduire si l'étoile possède une atmosphère.
3) Tracer, rapidement, avec seulement $2$ points, $\lambda$ en fonction de $x.$
4) En déduire le coefficient directeur de la droite ainsi que son ordonnée à l'origine. Donner alors l'équation numérique de $\lambda=ax+b$
5) A l'aide de l'équation numérique trouver les valeurs des longueurs d'onde émises par l'étoile.
6) Y-a-t-il de l'hydrogène ou de l'hélium dans l'étoile Véga ?
Conclure.
Données :
$-\ $ longueurs d'onde en $nm$ émise par l'élément $H$ : $398\ –\ 410\ -\ 434\ -\ 486$
$-\ $ longueurs d'onde en $nm$ émise par l'élément $He$ : $380\ –\ 403\ –\ 414\ -\ 447$
Exercice 11
On donne les spectres de deux éléments, le titane et le nickel, ainsi que le spectre d'une étoile.
Ces spectres ont été réalisés dans les mêmes conditions et les réglages du spectroscope étaient les mêmes.
1) Quel nom donne-t-on aux spectres des deux éléments ?
2) Expliquer l'allure du spectre de l'étoile en utilisant les mots ou les expressions suivantes : spectre (ou fond) continu ; raies d'absorption.
3) La comparaison du spectre de l'étoile et des spectres de chaque élément permet de faire une affirmation relative à la composition chimique de l'étoile.
Laquelle ?
Exercice 12
L'énergie des niveaux de l'atome $H$ est donnée par $E_{n}=-\dfrac{13.6}{n^{2}}(eV)$, avec $n$ entier non nul.
1. Représenter les $6$ premiers niveaux sur un diagramme à l'échelle $1\,cm$ pour $1eV.$
Ajouter le niveau $E=0eV$ correspondant à l'atome ionisé.
2. Calculer la longueur d'onde $\lambda$ d'un photon capable de provoquer la transition de l'atome $H$ de son niveau fondamental au niveau $n=3.$
Représenter cette transition sur le diagramme précédent.
3. Calculer la longueur d'onde correspondant à la transition du niveau $3$ au niveau $2.$
Donner le résultat en $nm.$
Cette transition correspond-elle à un photon émis ou absorbé ?
4. Cet atome étant de nouveau dans son état fondamental, il absorbe un photon de longueur d'onde égal à $8.5\cdot10^{-8}m.$
Comparer cette énergie à celle du niveau fondamental.
Montrer alors que l'électron est arraché à l'atome. Comment nomme-t-on ce phénomène ?
5. Quelle est l'énergie d'ionisation de l'atome d'hydrogène ?
6. Établir l'expression littérale de la longueur d'onde des radiations émises lorsque cet atome passe d'un état excité tel que $n>2$ à l'état $n=2$ correspondants à la série nommée série de Balmer.
7. L'analyse du spectre d'émission de l'atome d'hydrogène révèle la présence de radiations de longueur d'onde : $656\,nm\left(H_{\alpha}\right)$, $486\,nm\left(H_{\beta}\right)$, $434\,nm\left(H_{\lambda}\right)$, $410\,nm\left(H_{\sigma}\right)$
7.1. Déterminer à quelles transitions correspondent ces radiations de la série de Balmer.
7.2. Représenter ces transitions sur le diagramme des niveaux d'énergie de l'hydrogène.
8. Un photon d'énergie $7eV$ arrive sur un atome d'hydrogène.
Que se passe-t-il si l'atome est
a) dans l'état fondamental
b) dans l'état excité $n=2.$
9. Un gaz d'hydrogène atomique est porté à la température $2500\,K.$ On admet que les atomes d'hydrogène se trouvent dans leur état fondamental. Parmi les photons suivants dont on donne l'énergie quels sont ceux qui sont susceptibles d'être absorbés par les atomes : $8.5eV$, $10.2eV$, $13.2eV$, $13.4eV$, $14.5eV.$
Exercice 13
Dans le spectre d'émission de l'hydrogène, on trouve les trois raies suivantes caractérisées par leur longueur d'onde $\lambda_{1}=434.1\,nm$, $$\lambda_{2}=486.1\,nm$, $\lambda_{3}=656.3\,nm.$
1. A quel domaine du spectre électromagnétique appartiennent ces rayonnements lumineux ?
2. Calculer en $eV$, les énergies des photons de longueurs d'onde $\lambda_{1}=434.1\,nm$, $\lambda_{2}=486.1\,nm$, $\lambda_{3}=656.3\,nm.$
3. Justifier la discontinuité du spectre d'émission.
4. Donner le diagramme des niveaux d'énergie de l'atome d'hydrogène.
Donner l'expression des énergies des niveaux d'énergies, en calculant numériquement les énergies des niveaux $E_{i}$ de $i=1$ à $6.$
5. Sur le diagramme, noter quel est l'état fondamental, les états excités, l'énergie d'ionisation.
6. Montrer que les trois raies étudiées correspondent à des transitions qui ramènent l'atome d'hydrogène excité au même état.
7. Quelle doit être l'énergie du photon pour faire passer l'atome d'hydrogène du niveau $n=1$ à $n=4$ ?
Exercice 14
La mécanique quantique montre que l'état fondamental de l'atome d'hydrogène est caractérisé par une énergie $E_{1}=-13.6ev$ et chaque niveau excité $n>1$ est définie par une énergie $E_{n}=-\dfrac{E_{n}}{n^{2}}$ $(n$ est un entier naturel positif$)$ Avec $E_{0}=13.6eV.$
1. A quoi correspond l'énergie $E_{0}$ ?
2. Quelle relation simple existe entre l'énergie de transition $\Delta E$ d'un niveau $n$ à un niveau p et la longueur d'onde du photon émis ou absorbé. (Traiter chaque cas à part)
3.1. Montrer que pour une transition d'un niveau $p$ à un niveau $n$ tel que $p>n$, on peut écrire la relation $\dfrac{1}{2}=R_{H}\left(\dfrac{1}{n^{2}}-\dfrac{1}{p^{2}}\right).$
3.2. Vérifier que $R_{H}$ (appelée constante de Rydberg) vaut $R_{H}=1.10\cdot10^{+7}m^{-1}$
3.3. Dans la série de Balmer $($le retour au niveau $n=2)$ l'atome $H$ émet $1$ spectre contenant $4$ raies visibles, on se propose de calculer deux longueurs d'ondes de $2$ raies de ce spectre correspondant à $p=3$ $(\lambda_{3.2})$ et $p=4$ $(\lambda_{4.2})$
Sans faire de calcul, et en utilisant $\Delta E$, comparer $(\lambda_{3.2})$ et $(\lambda_{4.2})$ puis calculer leurs valeurs.
4. L'atome $H$ est dans son état fondamental $(n=1)$, on l'excite à l'aide d'un photon incident d'énergie $W=13.8eV.$
Que se passe-t-il ?
Calculer $($en $eV)$ l'énergie cinétique $E_{c}$ de l'électron de $H$ éjecté.
5. si l'atome entre en choc inélastique avec un électron ayant une énergie cinétique égale $11eV$, que se passe-t-il ?

Commentaires
Laurent Dakleu (non vérifié)
dim, 04/26/2020 - 04:23
Permalien
Alcool
Archange mampouya (non vérifié)
sam, 03/19/2022 - 19:04
Permalien
Télécharger ce document
Vladimir (non vérifié)
mar, 04/05/2022 - 10:57
Permalien
svp la correction des
hawadak (non vérifié)
jeu, 06/23/2022 - 01:26
Permalien
Exercices et corrigés
Mariéme Diop (non vérifié)
ven, 06/09/2023 - 21:59
Permalien
Exercice et corrigé
Ajouter un commentaire