Structure de la matière - 4e
Classe:
Quatrième
Situation problème
Cette photographie est celle d'une ville ; on y distingue à priori :
des bâtiments imposants dans un relief boisé au bord d'une mer avec sa belle plage.

I- Particule de matière
I-2. Expérience et observation
Observation 1
En versant un peu d'alcool dans un récipient, il
s'évapore au bout de quelques minutes et son
odeur envahit la saille.

Observation 2
En mettant un morceau de sucre ou sel dans de
l'eau et en remuant, le sucre ou le sel se dissout
L'eau est alors sucrée ou salée

Observation 3
En ajoutant quelques millilitres de colorant
dans de l'eau, en remuant, l'eau se colore

I-3. Interprétation
L'alcool, le sel, le sucre et le colorant sont constitués de particules très petites qui se sont dispersées assez rapidement dans leurs milieux respectifs.
Toutes ces expériences montrent alors que la matière, qu'elle soit liquide solide ou gaz, est constituée de grains qui peuvent se disperser : la matière est discontinue.
II- Différents types de grains de matière
II-1. Molécules
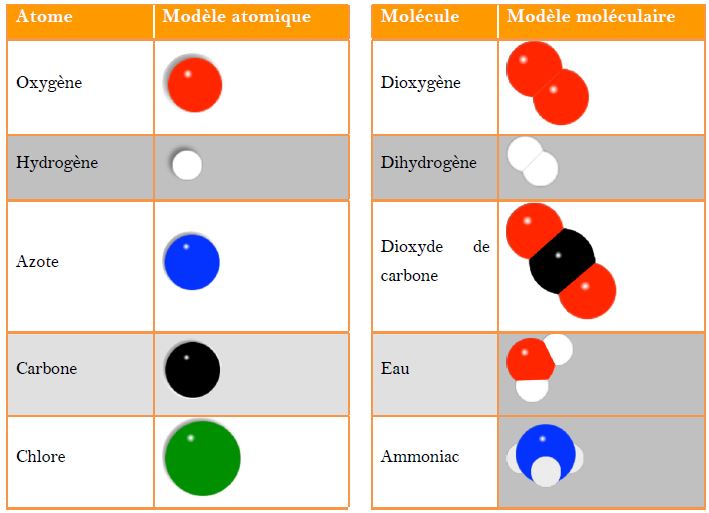
L'eau et le sucre et l'alcool sont constitués de petites particules électriquement neutres appelées molécules :
ce sont des composés moléculaires.
La molécule est la plus petite partie d'un corps pur qui puisse exister à l'état individuel et isolé tout en conservant la composition du corps pur.
II-2. Atomes
a) Notion d'atome
L'électrolyse de l'eau permet de la décomposer en deux gaz :
le dioxygène et le dihydrogène.
Ces deux gaz sont constitués respectivement de molécules de dioxygène et de dihydrogène.
La molécule d'eau est par conséquent constituée de particules plus petites qui peuvent s'assembler autrement pour donner ces gaz.
Ces particules sont appelées atomes.
Par exemple la molécule de dihydrogène est constituée de deux atomes d'hydrogène comme son nom l'indique ; de même, celle de dioxygène est faite de deux atomes d'oxygène.
Illustration par des modèles atomiques et moléculaires :
les atomes sont représentés par des boules sphériques de différentes couleurs et de différents diamètres, les molécules par ...
b) Structure de l'atome
L'atome comprend deux parties : un noyau central et, autour de ce dernier, un nuage électronique.
$\bullet\ $ Le noyau est chargé positivement.
Il concentre l'essentiel de la masse de l'atome bien que sa taille soit très petite par rapport à celle de l'atome.
$\bullet\ $ Le nuage électronique, de charge négative, est constitué d'électrons qui gravitent autour du noyau.
Sa masse est très petite par rapport à celle de l'atome ou du noyau.
Dans un atome, la charge électrique positive du noyau est égale à la valeur absolue de la charge du nuage électronique : la charge globale de l'atome est nulle.
On dit que l'atome est électriquement neutre.
II-3. Ions
a) Notion d'ion
$\bullet\ $ Expérience et observations
Dispositif expérimental
On réalise un circuit comprenant un générateur, une ampoule
et un électrolyseur contenant de l'eau sucrée

On réalise un circuit comprenant un générateur, une ampoule
et un électrolyseur contenant de l'eau salée

Observations :
on constate que la lampe du circuit comprenant l'eau salée (figure b) s'allume alors que celle du circuit comprenant l'eau sucrée est éteinte.
$-\ $ La lampe de la figure (b) s'allume car l'eau salée est traversée par le courant électrique.
Elle contient des grains de matières qui permettent le passage du courant : on les appelle : ions.
Ces ions forment le sel appelé chlorure de sodium.
C'est un composé ionique qui a deux ions : l'ion chlorure et l'ion sodium.
$-\ $ Par contre la lampe de la figure (a) ne s'allume pas parce que l'eau sucrée n'est pas traversée par le courant électrique : elle contient des grains de matières qui ne permettent pas le passage du courant :
on les appelle molécules.
b) Définition d'un ion
Les ions sont classés en deux groupes :
les ions positifs appelés cations et les ions négatifs appelés anions
$\bullet\ $ Les cations : Un cation est un atome ou un groupe d'atomes qui a perdu un ou plusieurs électrons.
Exemple :
$$\begin{array}{|l|l|l|}\hline\text{Cations}&&\\ \hline&&\text{L'atome de sodium perd un électron}\\ \text{Na}^{+}&\text{Ion sodium}&\text{et donne l’ion sodium qui porte}\\&&\text{une charge positive excédentaire.}\\ \hline&&\text{L'atome d’aluminium perd trois électrons}\\ \text{Al}^{3+}&\text{Ion aluminium}&\text{et donne l’ion aluminium qui porte}\\&&\text{trois charges positives de plus}\\ \hline\text{H}_{3}\text{O}^{+}&\text{Ion hydronium}&\\ \hline \text{NH}^{+}_{4}&\text{Ion ammonium}&\\ \hline\end{array}$$
$\centerdot$ Les anions : Un anion est un atome ou un groupe d'atomes qui a gagné un ou plusieurs électrons.
Exemple :
$$\begin{array}{|l|l|l|}\hline\text{Anions}&&\\ \hline&&\text{L'atome de chlore gagne un électron}\\&&\text{et donne l'ion chlorure qui porte une charge}\\ \text{Cl}^{-}&\text{Ion sodium}&\text{négative excédentaire.}\\&&\text{Cet ion se retrouve dans le sel de cuisine.}\\&&\text{Cet ion est caractéristique du goût salé du sel de cuisine}\\ \hline&&\text{L'atome d'oxygène gagne deux électrons}\\ \text{O}^{2-}&\text{Ion aluminium}&\text{et donne l'ion oxo qui porte}\\&&\text{deux charges négatives de plus}\\ \hline\text{OH}^{-}&\text{Ion hydroxyde}&\\ \hline\text{NO}^{-}_{3}&\text{Ion nitrate}&\\ \hline\text{SO}^{2-}_{4}&\text{Ion sulfate}&\\ \hline\text{CO}^{2-}_{3}&\text{Ion carbonate}&\\ \hline\end{array}$$
III- Élément chimique
III-1. L'élément carbone
a) Combustion du charbon de bois
Expérimentons et observons.
Le charbon de bois est pratiquement formé de carbone.
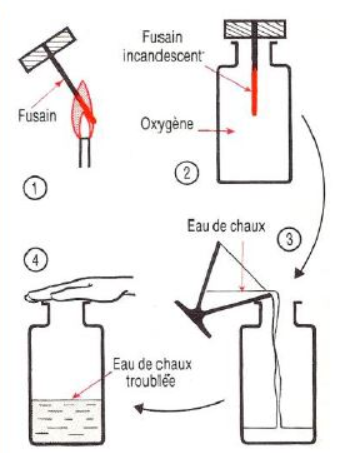
Chauffons un morceau de charbon de bois dans la flamme d'un bec de gaz (bec bunsen ou autre) et portons le ainsi à incandescence.
Introductions ainsi le ainsi dans un flacon rempli de dioxygène.
Il brule avec une très vive incandescence sans produire de flamme.
Il ne se forme pas de buée.
Une fois la combustion terminée, versons de l'eau de chaux dans le flacon, puis agitons ce dernier.
L'eau de chaux initialement limpide se trouble avec l'apparition d'un précipité blanc : le carbonate de calcium
Expliquons :
Le trouble de l'eau de chaux indique la présence de dioxyde de carbone, unique produit de la combustion du charbon de bois.
Concluons
du carbone et du dioxygène (gaz incolore) ont disparu ; du dioxyde de carbone (gaz incolore) s'est formé
b) Faisons réapparaitre le carbone
Expérimentons et observons.
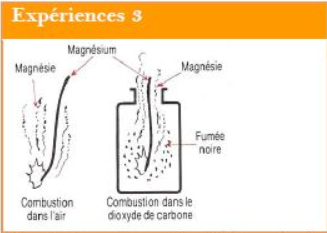
Un ruban de magnésium enflammé à l'air continue à bruler quand on le plonge dans le dioxyde de carbone.
Il apparait une fumée noire constitue par du carbone et une poudre blanche appelée magnésie.
C'est cette même poudre blanche qui se forme lorsque le ruban de magnésium brule à l'air
Expliquons :
la matière qui constitue le carbone est restée puisqu'elle a formé la fumée noire observée.
c) L'élément carbone
Nous appellerons élément carbone cette matière qui est présente dans le charbon, le dioxyde de carbone, le carbonate de calcium, la fumée noire et bien d'autres corps.
III-2. Les éléments chimiques et leurs symboles
Il existe environ une centaine d'éléments chimiques.
Certains sont très connus : fer, carbone, oxygène, etc...
D'autres le sont moins. Certains éléments comme le plutonium n'existent pas dans la nature :
ils sont fabriqués par l'homme. On dit qu'ils sont artificiels.
a) Symboles des éléments
On représente un élément chimique par un symbole.
Généralement c'est la première lettre en majuscule du nom actuel ou ancien d'origine latine.
Lorsque plusieurs éléments commencent par la même lettre, on ajoute à certains une deuxième lettre en minuscule.
Exemples de symboles avec une lettre
$$\begin{array}{|c|c|c|c|c|c|c|c|} \hline \text{Nom}&\text{Carbone}&\text{Oxygène}&\text{Phosphore}&\text{Soufre}&\text{Fluor}&\text{Azote}&\text{Potassium}\\ & & & & & &\text{(nitrogène)}&\text{(kalium)}\\ \hline \text{Symbole}&\text{C}&\text{O}&\text{P}&\text{S}&\text{F}&\text{N}&\text{K}\\ \hline \end{array}$$
Exemples de symboles d'éléments commençant par la même lettre
$$\begin{array}{|c|c|c|c|c|c|c|c|c|c|} \hline \text{Nom}&\text{Aluminium}&\text{Or (aurium) 1}&\text{Argon}&\text{Calcium}&\text{Chlore}&\text{Cuivre}&\text{Sodium}&\text{Néon}&\text{Nickel}\\ & & & & & & &\text{(natrium)}& &\\ \hline \text{Symbole}&\text{Al}&\text{Au}&\text{Ar}&\text{Ca}&\text{Cl}&\text{Cu}&\text{Na}&\text{Ne}&\text{Ni}\\ \hline \end{array}$$
Remarque :
Le symbole de l'élément représente l'élément et un atome de l'élément.
b) Formules chimiques
Les corps purs sont représentés par des formules chimiques.
Une formule chimique renseigne sur les éléments et le nombre d'atomes de chaque élément présent dans ce corps.
Exemples :
$$\begin{array}{|c|c|c|c|c|c|c|c|}\hline\text{Nom}&\text{Dioxygène}&\text{Dihydrogène}&\text{Chlorure}&\text{Eau}&\text{Soude}&\text{Glucose}&\text{Sulfate}\\&&&\text{de sodium}&&&&\text{d'aluminium}\\ \hline\text{Formule}&\text{O}_{2}&\text{H}_{2}&\text{NaCl}&\text{H}_{2}\text{O}&\text{NaOH}&\text{C}_{12}\text{H}_{22}\text{O}_{11}&\text{Al}_{2} (SO_{4})_{3}\\ \hline\end{array}$$
III-3. Corps purs simples et corps purs composés
a) Corps purs simples
Un corps pur est dit simple s'il est constitué à partir d'atomes d'un seul élément.
Exemples :
Dioxygène $(O_{2})$, Dihydrogène $(H_{2})$, Diazote $N_{2}$, les gaz rares (Néon $(Ne)$, Hélium $(He)$, Argon $(Ar)$...), Ozone $(O_{3})$, fer $(Fe)$...
b) Corps pur composé
Un corps pur est dit composé s'il est constitué à partir d'atomes de plusieurs éléments
Exemples :
Eau $(H_{2}O)$, Chlorure d'hydrogène $(HCl)$, gaz carbonique $(CO_{2})$, Soude $(NaOH)$, Glucose $(C_{12}H_{22}O_{11})\ldots$
Conclusion
La matière a une structure lacunaire, elle est formée de petites particules électriquement neutres appelées molécules.
Les molécules sont constitues d'atomes.
L'atome est formé d'un noyau chargé positivement et d'un nuage électronique chargé négativement.
Les atomes et les molécules peuvent gagner ou perdre des électrons et devenir des ions.
Il existe deux types d'ions : ion positif (cation) ; ion négatif (anion).
Les corps purs simples sont formés d'un seul type d'atomes appelé élément chimique.
L'élément est représenté par un symbole chimique.
Les corps purs composés sont formés de plusieurs éléments chimiques.
Il existe une centaine d'éléments naturels.
Source:
irempt.ucad.sn

Commentaires
Ousmane sankhare (non vérifié)
sam, 01/11/2020 - 09:34
Permalien
notes de cours
Baye serigne Diané (non vérifié)
jeu, 03/26/2020 - 13:55
Permalien
Plus de compréhension
Ndeye Maguette ... (non vérifié)
lun, 09/28/2020 - 19:59
Permalien
Erreur
Abdourahim DIOP (non vérifié)
jeu, 02/18/2021 - 11:45
Permalien
PC
yankinin abdoulaye (non vérifié)
mer, 03/10/2021 - 20:46
Permalien
remerciement
alexandre ouattara (non vérifié)
mer, 03/10/2021 - 20:49
Permalien
repondre
Anonyme (non vérifié)
jeu, 04/29/2021 - 03:13
Permalien
Merci de nous aide
coumba signaté (non vérifié)
sam, 05/22/2021 - 14:15
Permalien
samedi 04 /5/2021
Anonyme (non vérifié)
jeu, 06/17/2021 - 14:02
Permalien
merci beaucoup pour tous
ndiaye (non vérifié)
jeu, 06/17/2021 - 14:03
Permalien
phisique
Awa niane (non vérifié)
mer, 12/28/2022 - 22:49
Permalien
Pc
Awa niane (non vérifié)
mer, 12/28/2022 - 22:49
Permalien
Pc
Awa niane (non vérifié)
mer, 12/28/2022 - 22:51
Permalien
Pc
Awa niane (non vérifié)
mer, 12/28/2022 - 22:51
Permalien
Pc
Anonyme (non vérifié)
lun, 01/02/2023 - 21:48
Permalien
ggopo
Anonyme (non vérifié)
lun, 01/02/2023 - 21:48
Permalien
ggopo
Anonyme (non vérifié)
lun, 01/02/2023 - 21:48
Permalien
ggopo
Anonyme (non vérifié)
lun, 01/02/2023 - 21:48
Permalien
ggopo
Anonyme (non vérifié)
lun, 01/02/2023 - 21:48
Permalien
ggopo
Anonyme (non vérifié)
lun, 01/02/2023 - 21:48
Permalien
ggopo
Arame beye (non vérifié)
lun, 01/16/2023 - 19:12
Permalien
Pc
Arame beye (non vérifié)
lun, 01/16/2023 - 19:12
Permalien
Pc
Anonyme (non vérifié)
dim, 02/12/2023 - 21:47
Permalien
putainnnn
Sokhna Gueye (non vérifié)
lun, 04/22/2024 - 21:01
Permalien
Super intéressant
Sokhna Gueye (non vérifié)
lun, 04/22/2024 - 21:01
Permalien
Super intéressant
Laminethiam (non vérifié)
ven, 01/31/2025 - 23:56
Permalien
Sunudaara
Ajouter un commentaire