Solution des exercices : Structure de la matière - 4e
Classe:
Quatrième
Exercice 1
Complétons le texte suivant en ajoutant les mots ou groupes de mots manquants.
La matière a une structure discontinue. Parmi les corps purs on note des corps moléculaires dont la particule élémentaire est la molécule qui est constituée d'atomes.
Chaque type d'atome est appelé élément ; on le représente par un symbole chimique.
Un atome qui perd des électrons est appelé cation alors que celui qui en gagne est dit anion.
Exercice 2
La plus petite partie d'un corps pur est appelée : Molécule
Exercice 3
Soient les formules chimiques suivantes :
$$1)\ CH_{4}\qquad 2)\ O_{2}\qquad 3)\ NaOH$$
Donnons les noms des éléments chimiques contenus dans chaque corps purs et donnons le nombre d'atomes de chaque élément.
1) $CH_{4}$
$-\ \ $ Éléments chimiques :
$\centerdot\ \ C\ :$ Carbone
$\centerdot\ \ H\ :$ Hydrogène
$-\ \ $ Nombre d'atomes :
La molécule de $CH_{4}$ renferme 1 atome de carbone $(C)$ et 4 atomes d'hydrogène $(H).$ Ce qui donne 5 atomes au total.
2) $O_{2}$
$-\ \ $ Éléments chimiques :
$\centerdot\ \ O\ :$ Oxygène
$-\ \ $ Nombre d'atomes :
La molécule de $O_{2}$ renferme 2 atomes d'oxygène $(O).$
3) $NaOH$
$-\ \ $ Éléments chimiques :
$\centerdot\ \ Na\ :$ Sodium
$\centerdot\ \ O\ :$ Oxygène
$\centerdot\ \ H\ :$ Hydrogène
$-\ \ $ Nombre d'atomes :
La molécule de $NaOH$ renferme 1 atome de sodium $(Na)$, 1 atome d'oxygène $(O)$ et 1 atome d'hydrogène $(H).$ Ce qui donne au total, 3 atomes.
Exercice 4
Soient les formules chimiques suivantes :
$N_{2}\;;\ CO_{2}\;;\ Al_{4}C_{3}\;;\ Fe\;;\ O_{3}\;;\ HCl$ ;
$CaCO_{3}\;;\ H_{2}\;;\ S\;;\ Pb\;;\ H_{2}SO_{4}$
$CHCl_{3}\;;\ O_{2}\;;\ Cu.$
Complétons le tableau ci-dessous en écrivant la formule de chaque corps pur dans la colonne qui convient :
$$\begin{array}{|c|c|c|} \hline \text{Corps purs}&\text{Corps purs}&\text{Corps purs}\\ \text{simple}&\text{simple}&\text{Composés}\\ \hline \text{atomiques}&\text{moléculaires}&\\ \hline Fe\;,\ S&N_{2}\;,\ O_{3}&CO_{2}\;;\ Al_{4}C_{3}\\Pb\;,\ Cu&H_{2}\;,\ O_{2}&HCl\;,\ CaCO_{3}\\&&H_{2}SO_{4}\;,\ CHCl_{3}\\ \hline \end{array}$$
Donnons la composition de chacun des corps purs composés.
$CO_{2}\ :$ 1 atome de carbone $(C)$ et 2 atomes d'oxygène $(O).$
$Al_{4}C_{3}\ :$ 4 atomes d'aluminium $(Al)$ et 3 atomes de carbone $(C).$
$HCl\ :$ 1 atome d'hydrogène $(H)$ et 1 atome de chlore $(Cl).$
$CaCO_{3}\ :$ 1 atome de calcium $(Ca)$, 1 atome de carbone $(C)$ et 3 atomes d'oxygène $(O).$
$ H_{2}SO_{4}\ :$ 2 atomes d'hydrogène $(H)$, 1 atome de soufre $(S)$ et 4 atomes d'oxygène $(O).$
$CHCl_{3}\ :$ 1 atome de carbone $(C)$, 1 atome d'hydrogène et 3 atomes de chlore $(Cl).$
Exercice 5
Complétons le tableau suivant :
$$\begin{array}{|c|c|c|c|} \hline\text{Formule}&\text{Noms}&\text{Nombre}&\text{Nombre}\\ \text{chimique}&\text{éléments}&\text{d'atomes}&\text{total}\\ \text{du corps}&\text{chimiques}&\text{de chaque}&\text{d'atome}\\ \text{pur}&\text{présents}&\text{élément}&\text{dans le}\\ &\text{dans le}& &\text{corps}\\ &\text{corps}& &\\ \hline O_{2}&\text{Oxygène}&2&2\\ \hline NaCl&\text{Sodium}&1&2\\ &\text{Chlore}&1&\\ \hline H_{2}O&\text{Hydrogène}&2&3\\ &\text{Oxygène}&1&\\ \hline Fe_{3}O_{4}&\text{Oxygène}&4&7\\ &\text{Fer}&3&\\ \hline AlCl_{3}&\text{Aluminium}&1&4\\ &\text{Chlore}&3&\\ \hline Al_{2}(SO_{4})_{3}&\text{Aluminium}&2&\\ &\text{Soufre}&3&17\\ &\text{Oxygène}&12=(3\times 4)&\\ \hline Ca(NO_{3})_{2}&\text{Azote}&2&\\ &\text{Calcium}&1&9\\ &\text{Oxygène}&6=(2\times 3)&\\ \hline \end{array}$$
Exercice 6
Complétons cette grille de mots croisés
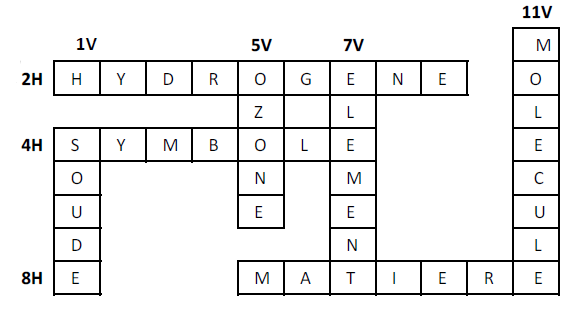
Exercice 7
Donnons la formule chimique de chacun des corps dont la molécule renferme :
$\centerdot\ $ Un atome de carbone et quatre atomes d'hydrogène.
$$CH_{4}$$
$\centerdot\ $ Un atome de sodium, un atome d'oxygène et un atome d'hydrogène
$$NaOH$$
$\centerdot\ $ Six atomes de carbone, douze atomes d'hydrogène et six atomes d'oxygène.
$$C_{6}H_{12}O_{6}$$
$\centerdot\ $ Un atome de calcium, deux atomes d'oxygène et deux atomes d'hydrogène.
$$Ca(OH)_{2}$$
$\centerdot\ $ Un atome de carbone et deux atomes d'oxygène.
$$CO_{2}$$
Exercices supplémentaires
Exercice A
Écrivons la formule chimique des corps dont les noms sont donnés ci-après :
$\rhd\ $ dioxyde de soufre : $SO_{2}$
$\rhd\ $ trioxyde de soufre : $SO_{3}$
$\rhd\ $ dioxygène : $O_{2}$
$\rhd\ $ trioxygène ou ozone : $O_{3}$
$\rhd\ $ monoxyde de carbone : $CO$
Exercice B : Savoir distinguer un corps pur simple d'un corps pur composé
Choisissez la bonne réponse :
$\rhd\ $ l'eau est un corps composé
$\rhd\ $ le dihydrogène est un corps simple
$\rhd\ $ il existe plusieurs corps simples contenant le même élément $(\text{Faux}$
Exercice 8 Maitrise de connaissances
Recopions et complétons les phrases suivantes à l'aide de la liste de termes :
composé ; négativement ; $10^{-10}\;m$ ; neutre ; ion ; simple ; positivement ; noyau ; électrons.
Un atome possède un noyau central chargé positivement et des électrons chargés négativement.
La charge des électrons compense celle du noyau ; l'atome est donc électriquement neutre.
Un ion est un atome qui a gagné ou perdu un ou plusieurs électrons.
Les dimensions de l'atome sont de l'ordre de $10^{-10}\;m.$
Un corps pur composé est formé d'atomes différents.
Un corps pur simple est formé d'atomes identiques.
Exercice 9 Symbole d'un élément chimique
1) Donnons le nom de l'élément correspondant à chacun des symboles suivants :
$$\begin{array}{|l|c|c|c|c|c|c|} \hline \text{Symbole}&Mg&Cl&Al&Ne&Ca&P\\ \hline \text{Nom}&\text{Magnésium}&\text{Chlore}&\text{Aluminium}&\text{Néon}&\text{Calcium}&\text{Phosphore}\\ \hline \end{array}$$
2) Donnons le symbole de chacun des éléments chimiques suivants :
$$\begin{array}{|l|c|c|c|c|c|c|} \hline \text{Elément}&\text{oxygène}&\text{hydrogène}&\text{azote}&\text{sodium}&\text{soufre}&\text{potassium}\\ \text{chimique}&&&&&&\\ \hline \text{Symbole}&O&H&N&Na&S&K\\ \hline \end{array}$$
Exercice 10 Formule chimique
Écrivons la formule chimique à partir de la composition de la molécule
$$\begin{array}{|l|c|} \hline \text{Composition de la molécule}&\text{Formule du corps pur}\\ \hline \text{2 atomes de chlore}&Cl_{2}\\ \hline \text{1 atome de soufre et 2 atomes d'oxygène}&SO_{2}\\ \hline \text{1 atome de carbone et 2 atomes d'oxygène}&CO_{2}\\ \hline \text{3 atomes d'oxygène}&O_{3}\\ \hline \text{1 atome d'azote et 3 atomes d'hydrogène}&NH_{3}\\ \hline \end{array}$$
Exercice 11 Signification d'une formule
Le sucre ou saccharose a pour formule moléculaire : $C_{12}H_{22}O_{11}$
Dans le tableau suivant, indiquons le nom et le nombre des différents atomes présents dans la molécule.
$$\begin{array}{|c|c|c|}\hline\text{Atomes présents}&\text{Nom}&\text{Nombre}\\ \hline C&\text{Carbone}&12\\ \hline H&\text{Hydrogène}&22\\ \hline O&\text{Oxygène}&11\\ \hline \end{array}$$
Exercice 12 Reconnaissance de formule
On considère les écritures suivantes : $O_{3}\;;\ 2O_{2}\;;\ 2O\;;\ O_{2}.$
Représentation des écritures :
1) Une molécule de dioxygène est représentée par : $O_{2}$
2) Deux atomes d'oxygène séparés sont représentés par : $2O$
Exercice 13 Classement selon l'atomicité
Indiquons l'atomicité des molécules suivantes
$$\begin{array}{|l|c|c|c|c|c|c|c|c|c|} \hline &N_{2}&HCl&Ne&H_{2}O&CO&O_{3}&He&NO_{2}&Cl_{2}\\ \hline \text{atomicité}&2&2&1&3&2&3&1&3&2\\ \hline \end{array}$$
Exercice 14 Corps pur simple et corps pur composé
Recopions et mettons une croix dans la case correspondant à la bonne réponse.
$$\begin{array}{|l|c|c|c|c|c|c|c|c|c|} \hline &H_{2}O&He&Cl_{2}&H_{2}&SO_{2}&Ne&NH_{3}&HCl&O_{3}\\ \hline \text{Corps pur simple}&&\times&\times&\times&&\times&&&\times\\ \hline \text{Corps pur composé}&\times&&&&\times&&\times&\times&\\ \hline \end{array}$$
Exercice 15 Entité chimique
On considère les entités chimiques suivantes :
$O_{3}\;;\ PO_{4}^{3^{-}}\;;\ SO_{4}^{2^{-}}\;;\ HO^{-}\;;\ NH_{3}\;;\ Fe^{3^{+}}\ \text{ et }\ H_{3}O^{+}.$
1) Classons-les en molécules, anions et cations dans le tableau suivant
$$\begin{array}{|c|c|c|}\hline\text{molécules}&\text{anions}&\text{cations}\\ \hline O_{3}\;;\ NH_{3}&PO_{4}^{3^{-}}\;;\ SO_{4}^{2^{-}}\;;\ HO^{-}&Fe^{3^{+}}\;;\ H_{3}O^{+}\\ \hline\end{array}$$
2) La charge électrique de chaque entité chimique est donnée dans le tableau ci-dessous
$$\begin{array}{|c|r|}\hline\text{entité chimique}&\text{charge}\\ \hline O_{3}&0\\ \hline NH_{3}&0\\ \hline PO_{4}^{3^{-}}&-3\\ \hline SO_{4}^{2^{-}}&-2\\ \hline HO^{-}&-1\\ \hline Fe^{3^{+}}&+3\\ \hline H_{3}O^{+}&+1\\ \hline\end{array}$$
Exercice 16 "un collier d'or"
Le diamètre d'un atome d'or est environ $0.144\;nm.$
Calculons le nombre minimal d'atomes d'or que l'on pourrait placer côte à côte pour obtenir une longueur $40\;cm$
Convertissons d'abord en unité internationale :
$1\;nm=10^{-9}\;m\ $ donc, $\ 0.144\;nm=0.144\cdot 10^{-9}\;m$
$1\;cm=10^{-2}\;m\ $ donc, $\ 40\;cm=40\cdot 10^{-2}\;m$
Ensuite, on sait que :
$$\begin{array}{rcl} 1\text{ atome d'or}&\text{occupe}&0.144\;nm\\ n\text{ atomes d'or}&\text{occupe}&40\;cm\end{array}$$
Enfin, en considérant les rapports de proportionnalité, on obtient :
$\dfrac{n}{1}=\dfrac{40\;cm}{0.144\;nm}.$ Ce qui donne alors : $n=\dfrac{40\;cm}{0.144\;nm}$
Or, $\ 0.144\;nm=0.144\cdot 10^{-9}\;m\ $ et $\ 40\;cm=40\cdot 10^{-2}\;m$
Donc, en remplaçant par les valeurs converties, on obtient :
$\begin{array}{rcl} n&=&\dfrac{40\cdot 10^{-2}\;m}{0.144\cdot 10^{-9}\;m}\\ \\&=&\dfrac{40\cdot 10^{-2}\times 10^{9}}{0.144}\\ \\&=&\dfrac{40\cdot 10^{7}}{0.144}\\ \\&\approx&2777777778\end{array}$
Ainsi, pour obtenir une longueur de $40\;cm$ on pourrait placer côte à côte, au minimum, $2777777778$ atomes d'or.
Exercice 17
La masse d'un noyau d'atome de cuivre est de $1.05\times 10^{-25}\;kg.$
Celle de l'ensemble de ses électrons est de $2.64\times 10^{-29}\;kg.$
1) Comparons la masse du noyau de l'atome de cuivre à celle de ses électrons en calculant le rapport masse noyau/masse des électrons.
On a :
$\begin{array}{rcl}\dfrac{m_{\text{noyau}}}{m_{\text{électron}}}&=&\dfrac{1.05\times 10^{-25}}{2.64\times 10^{-29}}\\ \\&=&\dfrac{1.05\times 10^{-25}\times 10^{29}}{2.64}\\ \\&=&\dfrac{1.05\times 10^{4}}{2.64}\\ \\&=&3977.27\end{array}$
Donc, $\boxed{\dfrac{m_{\text{noyau}}}{m_{\text{électron}}}=3977.27}$
Ce qui veut dire encore que : $m_{\text{noyau}}=3977.27\times m_{\text{électron}}$
Ainsi, nous constatons que la masse du noyau de l'atome de cuivre fait $3977.27$ fois plus que celle de ses électrons.
Par suite, la masse du noyau de l'atome de cuivre est largement supérieure à la masse de ses électrons.
2) Explication de la phrase suivante : "la masse de l'atome est concentrée en son noyau".
D'après la question précédente, la masse du noyau de l'atome de cuivre est environ $3977.27$ fois plus grande que la masse de l'ensemble de ses électrons.
Ce qui signifie que la masse des électrons reste négligeable devant celle du noyau.
Par conséquent, toute la masse de l'atome est quasiment déterminée par la masse du noyau.
D'où, la phrase suivante : "la masse de l'atome est concentrée en son noyau"
Exercice 18 Formule statistique d'un composé
Complétons le tableau ci-dessous en reliant la formule statistique du composé ionique à celles de ses ions.
$$\begin{array}{|c|c|c|c|c|} \hline &Na^{+}&Cu^{2^{+}}&Ca^{2^{+}}&Fe^{3^{+}}\\ \hline Cl^{-}&NaCl&CuCl_{2}&CaCl_{2}&FeCl_{3} \\ \hline SO_{4}^{2^{-}}&Na_{2}SO_{4}&CuSO_{4}&CaSO_{4}&Fe_{2}(SO_{4})_{3}\\ \hline OH^{-}&NaOH&Cu(OH)_{2}&Ca(OH)_{2}&Fe(OH)_{3}\\ \hline NO_{3}^{-}&NaNO_{3}&Cu(NO_{3})_{2}&Ca(NO_{3})_{2}&Fe(NO_{3})_{3}\\ \hline S^{2^{-}}&Na_{2}S&CuS&CaS&Fe_{2}S_{3}\\ \hline \end{array}$$

Commentaires
Anonyme (non vérifié)
jeu, 01/09/2020 - 14:47
Permalien
bien
Ousmane Sall (non vérifié)
jeu, 02/16/2023 - 10:10
Permalien
Excellent
Ouleye sow (non vérifié)
mer, 01/24/2024 - 15:39
Permalien
Eleve
Ndack seck (non vérifié)
mar, 03/04/2025 - 23:23
Permalien
Étudier
Youssou sy (non vérifié)
lun, 01/27/2020 - 19:27
Permalien
Cest important
Mens (non vérifié)
jeu, 04/22/2021 - 11:48
Permalien
Salut
Adam oumar (non vérifié)
mar, 12/13/2022 - 01:18
Permalien
Motivation
Sakho (non vérifié)
mar, 01/23/2024 - 18:41
Permalien
Le correction de l'exercice 8
Sakho (non vérifié)
mar, 01/23/2024 - 18:41
Permalien
Le correction de l'exercice 8
Sakho (non vérifié)
mar, 01/23/2024 - 18:41
Permalien
Le correction de l'exercice 8
Moussa Niang (non vérifié)
jeu, 01/30/2025 - 15:11
Permalien
sciences Physiques
Anonyme (non vérifié)
mar, 06/15/2021 - 23:16
Permalien
Très bonne Merci
Anonyme (non vérifié)
ven, 07/02/2021 - 13:52
Permalien
Classe 4ème excellent bon
Anonyme (non vérifié)
ven, 07/02/2021 - 13:52
Permalien
Classe 4ème excellent bon
Mame goumba sall (non vérifié)
dim, 03/13/2022 - 22:21
Permalien
Eleve de 4ème
Moussa (non vérifié)
mer, 03/16/2022 - 23:14
Permalien
Jaangen jeufeuti beg naniou
touresady0@gmail.com (non vérifié)
jeu, 04/07/2022 - 15:53
Permalien
MERCI C EST UNE BELLE
touresady0@gmail.com (non vérifié)
jeu, 04/07/2022 - 15:53
Permalien
MERCI C EST UNE BELLE
JUTA (non vérifié)
mer, 04/20/2022 - 00:16
Permalien
J'aime bien les exercices de
Poupée noir (non vérifié)
mar, 02/07/2023 - 21:28
Permalien
Apprendre
Anonyme (non vérifié)
jeu, 05/19/2022 - 20:11
Permalien
Tu es un vrai scientificien
Hamdou (non vérifié)
mer, 06/15/2022 - 02:17
Permalien
Scientifique
Mamadou Niang (non vérifié)
mer, 06/15/2022 - 23:04
Permalien
Bon boulot
ahmadou tidiane déme (non vérifié)
mar, 12/06/2022 - 22:17
Permalien
appréciation
Anonyme (non vérifié)
mer, 01/18/2023 - 17:27
Permalien
Comme toi
Ndeye Fatou niang (non vérifié)
mer, 01/18/2023 - 17:24
Permalien
Merci ses gentil yalna khame
Lamine (non vérifié)
jeu, 01/19/2023 - 18:37
Permalien
Élève
Liougavi (non vérifié)
mer, 04/17/2024 - 22:27
Permalien
Élève
Anonyme (non vérifié)
mer, 06/14/2023 - 23:12
Permalien
Merci yalna yalla Faye . se
Anonyme (non vérifié)
mer, 06/14/2023 - 23:12
Permalien
Merci yalna yalla Faye . se
Assietou (non vérifié)
mer, 01/17/2024 - 20:43
Permalien
Exercice français et anglais
Assietou (non vérifié)
mer, 01/17/2024 - 20:43
Permalien
Exercice français et anglais
Assietou (non vérifié)
mer, 01/17/2024 - 20:43
Permalien
Exercice français et anglais
Assietou (non vérifié)
mer, 01/17/2024 - 20:43
Permalien
Exercice français et anglais
Mamadou cissokho (non vérifié)
dim, 01/21/2024 - 19:31
Permalien
Je veux excellente élève
Anonym (non vérifié)
jeu, 03/21/2024 - 21:20
Permalien
Exercices
Une coréenne (non vérifié)
jeu, 01/08/2026 - 19:29
Permalien
Je suis totalement d'accord
Anonyme (non vérifié)
mar, 03/11/2025 - 21:09
Permalien
MERCI SUR VOS COURS ET
Malick Toure (non vérifié)
mer, 04/09/2025 - 14:07
Permalien
Remerciements
Ajouter un commentaire