Série d'exercices sur les alcools - Ts
Classe:
Terminale
Exercice 1
1) Déterminer la F.S.D, le nom et la classe de chacune isomère
2) On dispose de trois alcools $A_{1}$ ; $A_{2}$ et $A_{3}$ de formules semi développées respectives :
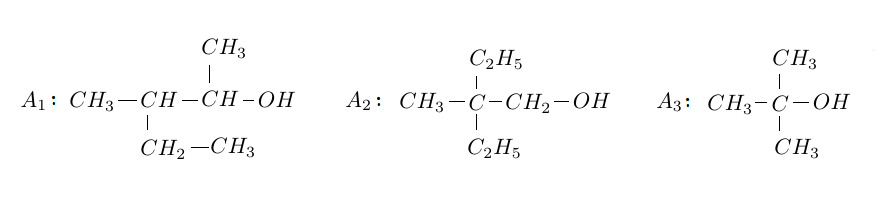
Donner le nom et la classe de chaque alcool.
3) On a réalisé l'oxydation ménagée de l'un des alcools précédents par une solution acidulée de permanganate de potassium $(K^{+}\ +\ MnO_{4}^{-})$, le produit formé a donné un précipité jaune avec la $2.4$ $D.N.P.H$ et n'a pas réagi avec le réactif de Schiff.
a) Préciser, en le justifiant, l'alcool utilisé.
b) Écrire l'équation (ou les équations) de la réaction (ou des réactions)) qui s'est (ou qui ont été) produite(s).
Donner le nom et la famille du (ou des) produit(s) formé(s).
4) La déshydratation intramolaire de l'alcool $A_{3}$ a donné un composé $(C).$
a) Écrire l'équation bilan de cette réaction en précisant ses conditions expérimentales.
b) Donner le nom et la famille chimique de $(C)$
Exercice 2
La combustion complète de $7.4\,g$ d'un alcool $(A)$ donne $17.6\,g$ de dioxyde de carbone.
1) Écrire l'équation de combustion complète de l'alcool $(A).$
Donner sa signification macroscopique.
2) Déterminer la formule brute de $(A).$
3) Donner les formules semi-développées, les noms et les classes de tous les alcools isomères correspondant à cetts formule brute.
4) L'oxydation ménagée de $(A)$ donne un composé $(B)$ qui réagit avec le $2.4-D.N.P.H$ et ne réagit pas avec la liqueur de Fehling.
a) Identifier l'alcool $(A)$, en justifiant la réponse.
b) Donner la formule semi-développée de $(B)$ et son nom.
5) Écrire l'équation de la réaction qui se produit.
b) Calculer la masse d'alcool consommée et la masse du produit récupéré par cette réaction.
On donne : $M_{Cl}=35.5\,g\cdot mol^{-1}.$
Exercice 3
L'analyse élémentaire d'un composé $(A)$ a donné $62%$ de carbone, $27.6\%$ d'oxygène et $10.4\%$ d'hydrogène.
1) Sachant que la masse molaire de $(A)$ est égale à $58\,g\cdot mol^{-1}$, déterminer la formule brute de $(A).$
2) Donner la formule semi-développé et le nom de chaque isomère répondant à la formule brute de $(A).$
3) Le composé $(A)$ réagit avec le réactif de Schiff.
Identifier $(A).$
4) Comment peut-on préparer $(A)$ à partir d'un alcool $(B).$
5) L'isomère $(B')$ de $(B)$ subit une oxydation ménagée par le dioxygène de l'air.
a) Décrire cette expérience et identifier les produits obtenus.
b) Écrire les équations de réaction.
Exercice 4
On réalise l'oxydation ménagée d'un alcool $(A)$ à quatre atomes de carbone par une solution de bichromate de potassium en milieu acide aqueux, on obtient un composé $(B)$ qui précipité au jaune le $2.4-D.N.P.H$ et ne réagit aps avec le réactif de Schiff.
1) Donner la formule brute de $(A).$
Donner sa formule semi-développé et son nom.
2) Écrire en formule semi-développé, l'équation de cette réaction et donner le nom du produit $(B).$
3) On chauffe l'isomère $(A')$ de $(A)$ à chaine ramifiée alcool primaire en présence d'acide sulfurique.
a) De quelle réaction s'agit-il ?
b) Écrire l'équation de la réaction et nommer les produits obtenus.
4) On réalise la combustion complète du composé $(A)$ dans un volume $v=0.4\,L$ de dioxygène.
a) Écrire l'équation de la réaction.
Exercice 5
La combustion complète de $0.37\,g$ d'un alcool $(A)$ nécessite un volume $V=0.72\,L$ de dioxygène dans les conditions de température et de pression où le volume molaire des gazs est égal à $24\,L\cdot mol^{-1}.$
1) a) Écrire l'équation de combustion complète de l'alcool $(A).$
b) Déterminer la formule brute de $(A).$
On donne $M(C)=12\,g\cdot mol^{-1}$, $M(H)=1\,g\cdot mol^{-1}$ et $M(O)=16\,g\cdot mol^{-1}.$
c) Donner les formules semi-développés, les noms et les classes de tous les alcools isomères correspondant à cette formule brute.
2) On réalise l'oxydation ménagée de $(A)$ par le dioxygène de l'air on obtient un composé $(B)$ qui réagit avec la $D.N.P.H$ et qui rosit le réactif de Sciff.
a) Décrire cette expérience.
b) Identifier l'alcool $(A)$ sachant que son isomère de position ne réagit pas au cous d'une oxydation ménagée.
c) Donner la formule semi-développée de $(B)$ et son nom.
d) L'oxydation ménagée de $(B)$ donne un composé $(C)$, donner le nom et la formule semi-développée de $(C).$
3) On réalise la déshydratation de l'alcool $(A)$ à une température de $180^{\circ}C$ on obtient un composé organique $(D).$
a) Écrire l'équation bilan de la réaction de combustion complète de $A$
b) Donner la famille, le nom et la formule semi-développée de $(D).$
4) On fait réagir l'alcool $(A)$ avec une quantité de chlorure d'hydrogène de masse $m.$
a) Écrire l'équation bilan de la réaction qui se produit.
b) Sachant que le volume du gaz utilisé est $V=0.36\,L$, calculer la masse d'alcool consommée et la masse $m$ du produit formé.
On donne : $M_{Cl}=35.\,g\cdot mol^{-1}$ ; $V_{m}=24\,L\cdot mol^{-1}.$
Exercice 6
On veut déterminer la formule brute d'une substance liquide $(A)$ composée uniquement des éléments carbone, hydrogène et oxygène.
1) Citer une expérience simple permettant de mettre en évidence les éléments carbone et hydrogène dans la substence $(A).$
2) On vaporise un échantillon de $(A)$ de masse $m=1.48\,g$, le gaz obtenu occupe un volume $V=0.48\,L$ dans les conditions où le volume molaire est $V_{m}=24\,L\cdot mol^{-1}.$
Calculer :
a) La quantité de matière de gaz obtenu.
b) La masse molaire de $(A).$
3) Pour déterminer la composition centésimale de la substance $(A)$ on réalise la combustion complète de l'échantillon précédent, on remarque que la masse du dioxyde de carbone dégagé est $m(CO_{2})=3.52\,g$ et que le volume de la vapeur d'eau dégagée est $V(H_{2}O)=2.4\,L$ dans les conditions où le volume molaire est $V_{m}=24\,L\cdot mol^{-1}.$
a) Calculer la masse et le pourcentage de carbone et d'hydrogène dans l'échantillon.
b) En déduire le pourcentage d'oxygène dans l'échantillon.
c) Déterminer la formule brute de la substance $(A).$
d) Écrire l'équation de la réaction de combustion de $(A.$
e) Calculer le volume nécessaire de dioxygène à cette combustion.
4) Déterminer la formule semi-développée, la classe et le nom de chaque isomère des alcools de formule brute $C_{4}H_{10}O.$
Exercice 7
au cours d'une séance de travaux pratiques de chimie et après avoir réalisé le tirage au sort, deux élèves.
Modou et Mariame ont eu le même sujet : " Identification d'un alcool $A$ ".
Le professeur a mis à leur disposition tout ce qu'il faut pour atteindre leur but qui est la détermination de la formule brute, la formule semi-développée, le nom et la classe de l'alcool $A.$
I. Démarche adoptée par Modou
1) Modou a réalisé une réaction avec l'alcool $A$, il a remarqué le dégagement d'un gaz $B$ qui décolore l'eau de dibrome.
a) Quelle est la famille chimique de $B.$
b) De quelle réaction s'agit-il ?
2) Pour déterminer la formule brute de l'alcool $A$, Modou a réalisé la combustion complète de $0.3\,g$ de l'alcool $A$, il a récupéré un volume $V=0.36\,L$ d'un gaz, qui trouble l'eau de chaux,dans les conditions ou le volume molaire est $V_{m}=24\,L\cdot mol^{-1}$
a) Écrire l'équation bilan de la combustion complète d'un alcool.
b) Montrer comment Modou a pu déterminer la formule brute de l'alcool $A.$
On donne $M(H)=l\,g\cdot mol^{-1}$ ; $M(C)=12\,g\cdot mol^{-1}$ et $M(O)=16\,g\cdot mol^{-1}.$
II. Démarche adoptée par MAriame
1) Tandis que Mariame a réalisé une réaction de l'alcool $A$ avec le dioxygène de l'air, elle a obtenu un produit $C$ qui, en présence de la $2.4-D.N.P.H$, a donné un précipité jaune, mais il est sans action sur le réactif de tollens.
a) Quelle est la nature du produit $C$ ?
b) De quelle réaction s'agit-il ?
c) Décrire cette réaction dans le cas d'un alcool primaire quelconque.
2) Pour trouver la formule brute de l'alcool $A$, Mariame a fait réagir $0.3\,g$ de l'alcool $A$ avec un excès de sodium, elle a récupéré une masse $m=5\,mg$ d'un gaz qui, en présence d'une flamme, provoque une légère détonation.
a) Écrire l'équation de la réaction du sodium avec un alcool quelconque.
b) Montrer comment Mariame a pu déterminer la formule brute de l'alcool $A.$
III. Résultats :
1) Quel est l'élève qui a pu atteindre le but fixé par le professeur.
2) Donner la formule semi développée, le nom et la classe de $A.$
3) En déduire la formule semi développée et le nom du produit $C.$
Exercice 8
Un monoalcool saturé $A$ a une densité de vapeur $d=3.03.$
1) L'oxydation ménagée de $A$ par une solution de dichromate de potassium acidifiée conduit à un composé de $B$ qui réagit avec la $2.4-D.N.P.H.$
a) Quelle peut être la fonction du composé $B$ ?
b) Écrire l'équation-bilan de la réaction d'oxydo-réducton qui a lieu.
2) On laisse réagir dans une étuve, une mélange de $0.5\,mol$ de l'alcool $A$ et $2.0\,mol$ d'acide éthanoique.
Au bout d'une journée, n'évoluant plus, la composition du mélange contient alors $1.6\,mol$ d'acide éthanoique.
Calculer la masse d'ester formé ainsi que le taux d'alcool estérifié.
3) Sachant que $A$ est un alcool secondaire à chaine ramifiée et dont la molécule possède un carbone asymétrique.
Identifier $A.$
$H\ :\ 1\,g\cdot mol^{-1}$ ; $O\ :\ 16\,g\cdot mol^{-1}$ ; $C\ :\ 12\,g\cdot mol^{-1}$

Commentaires
Rayana (non vérifié)
mer, 11/04/2020 - 18:17
Permalien
Exercice 1
Kanté (non vérifié)
jeu, 11/04/2021 - 21:52
Permalien
Bien
Anonyme (non vérifié)
jeu, 05/12/2022 - 10:06
Permalien
Aldehydes
Kone salia (non vérifié)
mar, 08/30/2022 - 20:48
Permalien
Exercice
Fatime (non vérifié)
mar, 03/26/2024 - 00:59
Permalien
Apprendre
Ouattara Kayatou (non vérifié)
lun, 03/13/2023 - 22:15
Permalien
exercice
KOFFI KEVIN (non vérifié)
sam, 12/16/2023 - 15:08
Permalien
BAC
Noufou (non vérifié)
mar, 07/16/2024 - 23:50
Permalien
Corrigé
Diomandé (non vérifié)
jeu, 08/15/2024 - 18:16
Permalien
Révision
Abdoul Aziz (non vérifié)
mer, 11/11/2020 - 02:58
Permalien
Correction des exercice.
Malick Fall (non vérifié)
sam, 11/14/2020 - 12:49
Permalien
Recherche d'exercice
Yeo assiata (non vérifié)
lun, 11/30/2020 - 21:24
Permalien
Sur les alcools
Bangoura Sekou ... (non vérifié)
mer, 11/03/2021 - 02:58
Permalien
Exercices
Bangoura Sekou ... (non vérifié)
mer, 11/03/2021 - 02:58
Permalien
Exercices
Hahhahah (non vérifié)
sam, 02/12/2022 - 23:45
Permalien
Heuzhzzg
Le Stéphanoir
ven, 08/12/2022 - 02:06
Permalien
Aide
Yapi Honorat (non vérifié)
sam, 02/10/2024 - 10:56
Permalien
Avoir une fois le BAC
Ange (non vérifié)
jeu, 09/12/2024 - 13:31
Permalien
Avoir une fois le bac
Yapi Honorat (non vérifié)
sam, 02/10/2024 - 10:57
Permalien
Avoir une fois le BAC
Yapi Honorat (non vérifié)
sam, 02/10/2024 - 11:17
Permalien
Avec une fois le BAC
Yapi Honorat Pacôme (non vérifié)
sam, 02/10/2024 - 11:35
Permalien
Je veux avoir une fois le BAC
Jean (non vérifié)
mer, 09/21/2022 - 21:08
Permalien
Salut sa va bien
Anonyme (non vérifié)
lun, 10/17/2022 - 13:05
Permalien
exellent
TCHinda (non vérifié)
mer, 04/05/2023 - 17:03
Permalien
Étude
Ouattara (non vérifié)
mer, 08/16/2023 - 02:04
Permalien
Si j'ai bien fait
Konaté (non vérifié)
mer, 09/27/2023 - 09:22
Permalien
Élève
Konaté (non vérifié)
mer, 09/27/2023 - 09:23
Permalien
Élève
Kla (non vérifié)
jeu, 10/12/2023 - 21:33
Permalien
Terminal
Troli (non vérifié)
ven, 11/10/2023 - 16:31
Permalien
Bac
Anonyme (non vérifié)
mer, 08/07/2024 - 02:13
Permalien
L'exercice est bon
Mohamed Zon (non vérifié)
ven, 09/12/2025 - 03:39
Permalien
J’aime votre site
Cheick B Diakité (non vérifié)
sam, 10/25/2025 - 16:47
Permalien
Merci beaucoup
Ajouter un commentaire