Série d'exercices : Classification quantitative des couples oxydant - réducteur ion métallique/métal - 1er s
Classe:
Première
Exercice 1
On donne les potentiels normaux d'oxydo-réduction $E_{0}$ des couples rédox suivant :
$Ag^{+}/Ag\ :\ 0.8\,V$ ;
$Zn^{2+}/Cu\ :\ 0.34\,V$ ;
$Zn^{2+}/Zn\ :\ -0.76\,V$ ;
$Al^{3+}/Al\ :\ -1.66\,V$ ;
1) Quel est par convention, le potentiel normal d'oxydo-réduction du couple
2) pour chaque couple rédox, identifier l'oxydant et le réduction ; présenter les résultats sous forme de tableau.
3) Écrire pour chacun des couples rédox précédents, la demi-équation de réduction.
4) Parmi les couples de réactifs suivants, rechercher ceux qui donneront lieu à une réaction spontanée.
Écrire dans ce cas l'équation d'oxydoréduction correspondante.
$Ag^{+}\ +\ Zn$
$Cu^{+}\ +\ H^{+}$
$Cu\ +\ Ag^{+}$
$Zn^{2+}\ +\ H_{2}$
$Al\ +\ Cu^{2+}$
$Zn\ +\ H^{+}$
5) On réalise les piles correspondants aux réaction spontanées de la question précédente.
Déterminer dans chaque cas l'anode et la cathode.
Calculer la force électromotrice de chacune d'elle.
(On présentera les résultats sous formes de tableau).
Exercice 2
1. On réalise le pile constituée
$\blacklozenge\ $ d'une tige de fer trempant dans une solution aqueuse de sulfate de fer $(II)$
$\blacklozenge\ $ d'une tige de zinc trempant dans une solution aqueuse de sulfate de zinc $(II)$, les deux solutions étant reliées par un pont salin
1.1. Écrire les deux demi-équations des couples rédox en présence.
Préciser le sens dans lequel chaque réaction a effectivement lieu lorsque la pile débite.
1.2. On branche un voltmètre comme indiqué sur la figure.
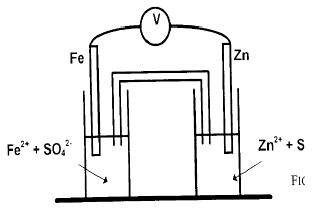
Préciser la polarité de la piles ; c'est-à-dire le signe $+$ ou $-$ de chacune des électrodes
2. Les constructeurs automobiles utilisent, pour la fabrication des carrosseries, des tôle d'acier galvanisées, assimilables à des plaques de fer sur lesquelles une couche de zinc recouvrant toute la surface a été déposée.
2.1. Le zinc empêche-t-il la corrosion du fer ?
Pourquoi ?
La protection reste-t-elle efficace Si, à la suite d'un choc par exemple, la couche de zinc est interrompue ?
2.2. A la place du zinc, on dépose de la même manière une couche de chrome sur une tôle de fer.
Le chrome empêche-t-il la corrosion du fer ?
Pourquoi ?
La protection reste-t-elle efficace Si la couche de chrome est interrompue ?
2.3. Mêmes questions pour le nickelage des tôles de fer.
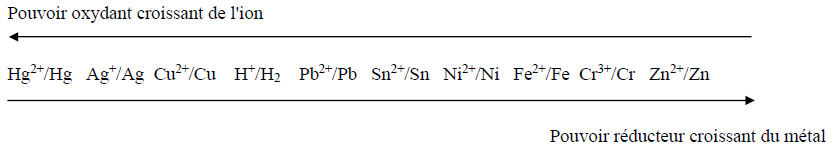
Exercice 3
On place $m=50\,mg$ de cuivre dans une solution de chlorure d'or $\left(AuCl_{3}\right)$ de volume $V=100\,ml$ et de concentration $c=10^{-2}mol/L.$
On agite jusqu'à ce que la réaction soit terminée.
On sait que les potentiels normaux des couples $Au^{3+}/Au$ et $Cu^{2+}/Cu$ sont respectivement $E_{1}=1.5\,V$ et $E_{2}=0.34\,V.$
La masse molaire de $Cu\ :\ M(Cu)=63.5\,g/mol.$
1. Montrer que le cuivre est attaqué (justifier la réponse).
2. Écrire l'équation-bilan de cette réaction chimique.
3. Déterminer le nombre de moles initial $M_{1}$ de moles de cuivre.
4. Déterminer le nombre de moles initial $M_{2}$ d'ions $Au^{3+}$ présents dans la solution de chlorure d'or.
5. Déterminer le réactif introduit en excès
Exercice 4
1. On se propose de déterminer la durée $t$ pour obtenir un dépôt d'argent.
L'intensité $I$ du courant électrique est réglée à $2\,A.$
La masse $m$ du dépôt est $1.875\,g.$
La valeur absolue de la charge de l'électron $e$ est égale à $1.6\cdot 10^{-19} C.$
Le nombre d'Avogadro $N$ a pour valeur $6.02\cdot 10^{23}.$
La masse molaire atomique du métal déposé $M$ est égale à $108\,g/mol.$
On utilise, pour un dépôt d'argent, la formule suivante $\dfrac{It}{Ne}=\dfrac{m}{M}$ dans laquelle $t$ est en secondes et les autres grandeurs dans les unités indiquées ci-dessus :
Calculer le temps $t$ nécessaire à l'opération.
2. On indique la classification des métaux selon leur potentiel d'oxydoréduction :
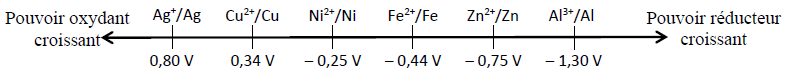
Après avoir lu le document concernant la Statue de la Liberté de la page suivante, répondre aux questions suivantes :
Document : La Statue de la Liberté en péril : la corrosion
C'est en $1870$ que BARTHOLDI réalise le tout premier modèle de la Statue de la Liberté actuelle.
Elle est érigée en pleine mer, au large de Manhattan, sur l'île de Bedloe à New-York.
L'atmosphère qui règne à cet endroit s'explique par un air marin humide et salé, par les vapeurs acides d'une raffinerie de pétrole voisine, par l'air humide et acide exhalé par des millions de visiteurs et l'eau qui pénètre jusqu'à l'ossature de la statue par les fenêtres de la torche.
La statue, haute de $93$ mètres, est en feuilles de cuivre de largeur $1.40\,m$ et d'épaisseur $2.37\,mm.$
Elle est construite avec $8$ tonnes de feuilles de cuivre biseautées.
La statue est soutenue par un pylône en fer auquel se trouve fixé un treillis également en fer pour soutenir l'enveloppe de cuivre.
L'architecte EIFFEL, auteur de l'œuvre, a fait poser un isolant entre le support (fer) et l'enveloppe (cuivre).
L'isolant n'a pas résisté à l'usure du temps : l'humidité s'y est installée, puis fer et cuivre sont entrés en contact.
Il en résulte qu'en de nombreux points de l'enveloppe, plusieurs rivets de cuivre ont sauté en y laissant des trous importants.
La corrosion de la charpente est aggravée par la nature du fer du siècle dernier qui était moins raffiné qu'aujourd'hui.
A la seconde restauration de la statue en $1986$, des solutions mécaniques et électrochimiques ont été apportées pour lui rendre une bouffée d'oxygène
2.1. Entre les deux éléments métalliques entrant dans la constitution de la statue, indiquer celui qui possède le plus grand pouvoir réducteur.
2.2. Écrire l'équation bilan de l'oxydoréduction de ces deux éléments.
2.3. En laboratoire, on réalise une pile électrochimique ayant pour électrodes une lame de fer et une lame de cuivre plongées chacune dans une solution électrolytique comme le montre le schéma ci-dessous.
a) Donner le nom du métal constituant l'électrode positive de cette pile.
b) Préciser et justifier le sens de circulation des électrons dans le circuit.
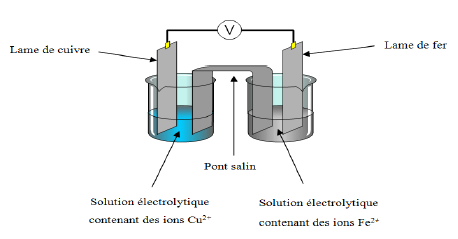
3. Le vieillissement du treillis (de la statue) dans le temps nécessite une protection contre la corrosion.
Parmi plusieurs méthodes envisagées, il a été choisi d'installer une anode sacrificielle en zinc.
Expliquer pourquoi le zinc protège le fer et écrire l'équation de la réaction d'oxydoréduction correspondante.
4. Pour décaper un lot de pièces en métal ferreux, une entreprise utilise une solution d'acide chlorhydrique de concentration $0.015\,mol/L.$
Calculer le $pH$ de cette solution d'acide fort.
Exercice 5
On donne
$E^{\circ}\left(Ni^{2+}/Ni\right)=-0.25\,V$
$E^{\circ}\left(Zn^{2+}/Zn\right)=-0.76\,V$
$E^{\circ}\left(Pb^{2+}/Pb\right)=-0.25\,V$
1. On réalise la pile $P_{1}$ symboliser par $Ni|Ni^{2+}\left(0.01\,mol\cdot L^{-1}\right)||Fe^{2+}\left(1\,mol\cdot L^{-1}\right)|Fe.$
On constate que le courant circule dans un circuit extérieur de l'électrode de nickel vers l'électrode de fer.
1.1. Indiquer la polarité des électrodes.
En déduire les modifications survenues dans chaque compartiment de la pile.
Écrire l'équation de la réaction spontanée, qui se produit dans la pile $P_{1}.$
1.2. Monter que le potentiel normal du couple $Fe^{2+}/Fe$ est inférieur à une valeur que l'on déterminera.
En déduire si le fer est attaqué par une solution d'acide ou non ?
2. On plonge maintenant une lame de zinc dans une solution contenant des ions $Fe^{2+}.$
On constate la formation d'un dépôt.
2.1. Comparer les potentiels normaux des couples $Fe^{2+}/Fe$ et $Zn^{2+}/Zn.$
2.2. Dire si on observe une réaction chimique quand on plonge une lame de fer dans une solution contenant des ions $Pb^{2+}.$
3. On réalise la pile $P_{2}$ en associant les deux couples $Fe^{2+}/Fe$ (placé a gauche) $Zn^{2+}/Zn$ (placé a droite)
3.1. Donner le symbole de la pile $P_{2}$ et écrire l'équation chimique associé a cette pile.
3.2. Calculer $E^{\circ}\left(Fe^{2+}/Fe\right)$ sachant que la f.e.m de la pile $P_{2}$ est $E_{2}=0.32\,V$ quand $\left[Fe^{2+}\right]=1\,mol\cdot L^{-1}$ et $\left[Zn^{2+}\right]=1\,mol\cdot L^{-1}.$
Exercice 6
En utilisant la technique du dosage manganimétrique, on se propose de déterminer la concentration molaire $C_{1}$ d'une solution $(S_{1})$ de sulfate de fer $(II)$ $\left(FeSO_{4}\right)$ de volume $V_{1}=10\,ml.$
Le matériel dont on dispose est :
$-\ $ Une burette graduée
$-\ $ Un erlenmeyer
$-\ $ Une pipette jaugée de $10\,ml$
$-\ $ La solution de permanganate de potassium $KMnO_{4}$ de concentration molaire $C_{2}=0.01\,mol\cdot L^{-1}.$
$-\ $ Une solution aqueuse concentrée d'acide sulfurique $H_{2}SO_{4}.$
1) Donner le schéma annoté du dispositif en précisant la solution dosant et l'espèce à doser.
Préciser le rôle de $H_{2}SO_{4}$
2) a) Écrire l'équation de la réaction rédox qui a lieu lors du dosage
b) A l'équivalence rédox, le volume de la solution dosant est $V_{2}=2\,0mL.$
c) Comment reconnaître l'équivalence rédox
d) déterminer la valeur de $C_{1}$
La pile électrochimique schématisée par la figure ci-dessous est constituée par :
$-\ $ Une demi-pile formée de la solution $(S_{1})$ dans laquelle on plonge une lame de fer.
$-\ $ Une demi-pile formée par une solution de concentration molaire $C_{3}=1\,mol\cdot L^{-1}$ d'ion $Cu^{2+}$ dans laquelle on plonge une lame de cuivre.
$-\ $ Un pont salin contenant une solution saturée de nitrate de potassium $\left(K^{+}\;,\ NO^{3-}\right)$
$-\ $ Le circuit extérieur à la pile est constitué d'un résistor $R$, d'un interrupteur $K$ et d'un ampèremètre
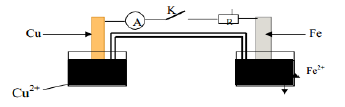
1) Donner le symbole de ce schéma de pile ainsi que l'équation chimique associée.
2) La f.é.m. de la pile est $E=0.78\,V.$
a) Déterminer la polarité des bornes de la pile
b) Écrire la transformation chimique qui se produit dans chaque compartiment de la pile après la fermeture de $K.$
En déduire l'équation bilan de la réaction chimique spontanée quand la pile débite un courant
c) Préciser le rôle du pont salin
d) Reproduire le schéma de la figure 1 ($K$ fermé) en précisant le sens du courant et des électrons dans le circuit
Exercice 7 : Pile chrome argent
Une pile d'oxydo-réduction est constituée en associant les deux demi-piles suivantes :
$-\ $ Une lame de chrome trempant dans $100\,mL$ de solution de nitrate de chrome $III$ de concentration $0.100\,mol\cdot L^{-1}.$
$E^{\circ}\left(Cr^{3+}/Cr\right)=-0.74\,V$
$-\ $ Un fil d'argent trempant dans $100\,mL$ de solution de nitrate d'argent de concentration $0.100\,mol\cdot L^{-1}.$
$E^{\circ}\left(Ag^{+}/Ag\right)=0.80\,V$
Les deux demi-piles sont reliées par un pont salin contenant une solution gélifiée de nitrate de potassium $\left(K^{+}+NO^{3-}\right).$
1. Définir le "potentiel standard" d'un couple oxydant-réducteur.
Calculer la f.é.m. de cette pile.
2. Faire un schéma de la pile en justifiant les polarités des électrodes.
Quelles sont les charges qui circulent à l'intérieur et à l'extérieur de la pile, lorsque celle-ci débite ? (Indiquer leur sens de déplacement sur le schéma)
3. Écrire les équations-bilan des réactions qui ont lieu dans chaque demi-pile ainsi que l'équation du bilan de la réaction chimique.
4. Au cours du fonctionnement de la pile, la masse d'une des électrodes diminue de $80.2\,mg.$
4.1. Quelle est cette électrode ?
4.2. Calculer la variation de masse de l'autre électrode.
4.3. Quelle est alors la concentration $C_{1}$ en ion $Ag^{+}$ ?
4.4. Quelle est alors la concentration $C_{2}$ en ion $Cr^{3+}$ ?
$\left(M_{Ag}=108\,g\cdot mol^{-1}\text{ et }M_{Cr}=52\,g\cdot mol^{-1}\right)$
Exercice 8 : Gouttière en cuivre ou gouttière en zinc : que choisir ?
Le zinc des gouttières s'abime sous l'action des pluies acides
En plongeant une lame de zinc dans une solution aqueuse d'acide, on constate une disparition progressive du métal et un dégagement gazeux (qui explose à la moindre étincelle).
A. Action des pluies acides sur le zinc
Les deux couples oxydant/réducteur mis en jeu sont : $H^{+}(aq)/H_{2}(g)$ de potentiel rédox $E_{0}=0.00\,V$ et $Zn^{2+}(aq)/Zn(s)$ de potentiel rédox $E_{0}=-0.76\,V$
1. L'association de ces deux couples constitue une pile.
1.1. Quelle serait la borne moins de cette pile ?
1.2. Donner la valeur de la force électromotrice E attendue pour cette pile.
2. A quelle borne de la pile y a-t-il oxydation ?
3. Donner l'équation globale de la réaction de fonctionnement de cette pile.
B. Action des pluies acides sur le cuivre
Les deux couples oxydants/réducteurs mis en jeu sont : $H^{+}(aq)/H_{2}(g)$ de potentiel rédox $E_{0}=0.00\,V$ et $Cu^{2+}(aq)/Cu(s)$ de potentiel rédox $E_{0}=+0.34\,V.$
1. L'association de ces deux couples constitue une pile.
Quelle est la valeur de la force électromotrice $E$ attendue pour cette pile.
2. A quelle borne de la pile y a-t-il réduction ?
3. Donner l'équation globale de la réaction de fonctionnement de cette pile.
C. Conclusion
1. Quel est le gaz dégagé qui explose dans l'air à la moindre étincelle lorsque l'on plonge le zinc dans une solution acide ?
2. Expliquer pourquoi, indépendamment du coût, la gouttière en cuivre sera préférée à la gouttière en zinc dans les régions ou les pluies acides sont fréquentes

Commentaires
Daouda Thiam (non vérifié)
dim, 04/20/2025 - 08:45
Permalien
Je suis étudiant et je
Ajouter un commentaire