Notion de couple oxydant-réducteur - 1er L
Classe:
Première
I. Réaction d'oxydoréduction
1. Action du métal zinc sur les ions cuivre $II$
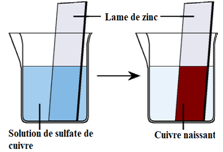
1.1. Expérience
Dans un bécher contenant une lame de zinc $(Zn)$, versons une solution de sulfate de cuivre $\left(Cu^{2+}\;,\ SO_{4}^{2-}\right).$

1.2. Observations
La lame de zinc $(Zn)$ se recouvre rapidement d'une pellicule brun-rouge de cuivre $(Cu)$ sous forme naissante, et la solution de sulfate de cuivre se décolore.
1.3. Interprétation
La décoloration et l'apparition de la pellicule brun-rouge indique que les ions cuivre $II$ $\left(Cu^{2+}\right)$ sont passés sous forme métallique $Cu$ en gagnant des électrons
$Cu^{2+}\ +\ 2e^{-}\ \longrightarrow\ Cu$
Dans le même temps, du zinc $(Zn)$ passe sous forme d'ions zinc $II$ $\left(Zn^{2+}\right)$ en perdant des électrons ; la solution donne un précipité en d'une solution d'hydroxyde de sodium
$Zn\ \longrightarrow\ Zn^{2+}\ +\ 2e^{-}$
La réaction chimique responsable de cette transformation se traduit par l'équation :
$$Cu^{2+}\ +\ Fe(s)\ \longrightarrow\ Cu(s)\ +\ Fe^{2+}$$
2. Action des ions argent $Ag^{+}$ sur le métal cuivre
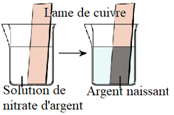
2.1. Expérience
Dans un bécher contenant une lame de cuivre $(Cu)$, versons une solution de nitrate d'argent $\left(Ag^{+}\;,\ NO_{3}^{-}\right)$

2.2. Observations
La lame de cuivre $(Cu)$ se recouvre rapidement d'une poudre noire d'argent métallique $(Ag)$ sous forme naissante, les ions argent $\left(Ag^{+}\right)$ sont passés sous forme métallique $(Ag).$
Dans le même temps, du cuivre $(Cu)$ passe sous forme d'ions cuivre $II$ $\left(Cu^{2+}\right)$, la solution se teinte légèrement en bleu
2.3. Interprétation
Il se produit un transfert d'électrons du cuivre $(Cu)$ aux ions argent $\left(Ag^{+}\right)$ :
Les atomes de cuivre cèdent chacun deux électrons et se transforment en ions cuivre $(II)$
$$Cu\ \longrightarrow\ Cu^{2+}\ +\ 2e^{-}$$
Simultanément, les ions argent $Ag^{+}$ captent ces électrons et se transforment en atomes d'argent.
$$2Ag^{+}\ +\ 2e^{-}\ \longrightarrow\ 2Ag$$
Les aiguilles formées sont constituées d'argent métallique $Ag(s).$
Le bleuissement de la solution est dû à la formation d'ions cuivre $Cu^{2+}.$
L'équation de cette réaction est : $$2Ag^{+}\ +\ Cu\ \longrightarrow\ 2Ag\ +\ Cu^{2+}$$
Le passage entre métal et cation métallique nécessite un transfert d'électrons, cette réaction est bien une réaction d'oxydoréduction.
3. Définitions
$\blacktriangleright $Un oxydant est une espèce chimique capable de capter un ou plusieurs électrons au cours d'une transformation chimique
$\blacktriangleright $Un réducteur est une espèce chimique capable de céder un ou plusieurs électrons au cours d'une transformation chimique
$\blacktriangleright $Une oxydation est une perte d'électrons
$\blacktriangleright $Une réduction est un gain d'électrons
$\blacktriangleright $Les réactions d'oxydoréduction sont des réactions de transfert d'électrons entre un oxydant et un réducteur.
II. Couple oxydant-réducteur ion métallique/métal
1. Notation
Au cours de la $1^{er}$ expérience, nous avons vu que : $$Cu^{2+}\ +\ 2e^{-}\ \longrightarrow\ Cu.$$
Les ions $Cu^{2+}$ jouent le rôle d'oxydant.
Au cours de la $2^{ième}$ expérience, nous avons vu que : $$Cu\ \longrightarrow\ Cu^{2+}\ +\ 2e^{-}.$$
$Cu$ joue le rôle de réducteur.
On constante donc que selon les réactions il y a passage de l'ion $Cu^{2+}$ (oxydant) au métal cuivre $Cu$ (réducteur) ou l'inverse.
Les ions cuivre et le cuivre métallique constituent un couple oxydant/réducteur ou couple rédox, noté $Cu^{2+}/Cu.$
De manière générale, on appelle couple oxydant/réducteur ou couple redox, noté $Ox/Red$, deux entités chimiques qui se transforment l'une en l'autre par transfert d'électrons.
2. Demi-équation électronique
Dans certaines conditions, on peut transformer le cuivre (métal) en ion cuivre $II$ (ion métallique) correspondant et inversement.
Ceci se traduit par une seule demi-équation d'oxydoréduction :
$$Cu^{2+}\ +\ 2e^{-}\ \leftrightarrows\ Cu$$
Pour formaliser le passage de l'état oxydé à l'état réduit et inversement, on écrit la demi-équation électronique :
$$M^{n-}\ +\ ne^{-}\ \leftrightarrow\ M$$
Remarque
Cette écriture est une schématisation, elle ne traduit pas la réalité car les électrons n'existent pas en solution aqueuse.
3. Exemples de couples redox et écriture des demi-équations redox correspondantes
$$\begin{array}{|l|l|} \hline \text{Couples redox}&\text{Demi-équation redox}\\ \hline Ag^{+}/Ag&Ag^{+}\ +\ e^{-}\ \leftrightarrows\ Ag\\ \hline Fe^{2+}/Fe&Fe^{2+}\ +\ 2e^{-}\ \leftrightarrows\ Fe\\ \hline Cu^{2+}/Cu&Cu^{2+}\ +\ 2e^{-}\ \leftrightarrows\ Cu\\ \hline Zn^{2+}/Zn&Zn^{2+}\ +\ 2e^{-}\ \leftrightarrows\ Zn\\ \hline Na^{+}/Na&Na^{+}\ +\ e^{-}\ \leftrightarrows\ Na\\ \hline Al^{3+}/Al&Al^{3+}\ +\ 3e^{-}\ \leftrightarrows\ Al\\ \hline \end{array}$$

Commentaires
Ngomamadou174@g... (non vérifié)
sam, 04/08/2023 - 11:00
Permalien
C'est tres jolie mais
Ajouter un commentaire