Mélanges et Corps pur - 2nd L
Classe:
Seconde
I. Mélange
1. Définition
Un mélange est un ensemble de deux ou plusieurs constituants.
Il peut être solide, liquide ou gaz
2. Mélange hétérogène
Un mélange hétérogène est un mélange dans lequel on peut distinguer à l'œil nu ses différents constituants.
Exemples :
eau$+$huile ; eau$+$terre ; boissons gazeuses

3. Mélange homogène (solution)
Un mélange homogène est un mélange dans lequel on ne peut pas distinguer à l'œil nu ses différents constituants.
Exemples :
lait ; sirop ; thé

Remarques
Une solution est un mélange homogène constitué de soluté $(S)$ et de solvant.
Le soluté est l'espèce dissoute.
Il peut être solide, liquide ou gaz.
Le solvant est l'espèce qui dissout.
Lorsque le solvant est l'eau, la solution obtenue est dite solution aqueuse.
II. Techniques de séparation
Il existe de nombreuses méthodes variables de séparation selon la nature du mélange et la nature des constituants qui le constituent.
Parmi ces méthodes, on cite :
1. Décantation
La décantation est une de séparation qui consiste à laisser le mélange au repos pour que les particules solides lourdes se déposent au fond du récipient.
En transvasant, on peut séparer le liquide de ces particules.
Le produit de la décantation est appelé décantat
Exemples de décantation
$-\ $Décantation d'un mélange solide-liquide : jus d'orange
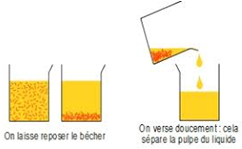
$-\ $Décantation d'un mélange liquide-liquide :
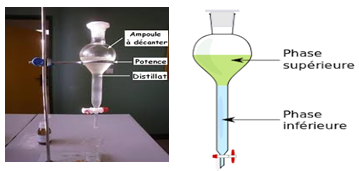
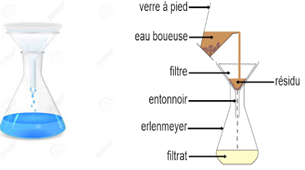
2. Filtration
La filtration est une méthode de séparation qui consiste à faire passer le mélange liquide à travers un filtre.
Le produit de la filtration est appelé filtrat
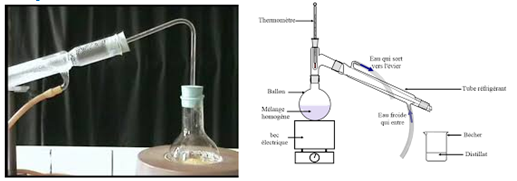
3. Distillation
La distillation est une méthode de séparation basée sur la différence de température d'ébullition.
Elle consiste à vaporiser partiellement un mélange liquide homogène et à condenser les vapeurs formées pour les séparer.
Le produit de la distillation est appelé distillat
Exemple :
distillation de l'eau sucrée
Remarque :
L'air est donc un mélange dont l'expérience montre qu'il est constitué de $78\%$ de diazote $(4/5$ en volume$)$, de $21\%$ de dioxygène $(1/5$ en volume$)$ et $1\%$ d'autres gaz (gaz rares, dioxyde de carbone et de la vapeur d'eau)
4. Quelques autres méthodes de séparation
4.1. La congélation
C'est une méthode de séparation basée sur la différence de cristallisation (température à laquelle un corps se congèle).
Le corps dont sa température d'ébullition est plus grande est récupéré le premier sous formes de cristaux.
4.2. Le tamisage
Si les grains de différents solides ont des dimensions différentes, le passage au tamis permet de les séparer
4.3. La flottation
On mouille le mélange.
Selon le liquide choisi, certaines particules flottent
4.4. Le triage magnétique
Si un des constituants du mélange contient du fer, les particules de ce constituant sont attirées par l'aimant
III. Corps purs
1. Corps pur
Un corps pur est un corps qu'on ne peut pas fractionner par une méthode quelconque de séparation
2. Critères de pureté d'un corps pur
Tout corps pur est défini par les constantes physiques parmi lesquelles on citer :
$-\ $la masse volumique
$-\ $les points de changement d'état : température de fusion, d'ébullition, de solidification etc$\cdot$
Exemple :
Valeurs de quelques constantes physiques de l'eau pure.
$-\ $masse volumique : $1\,kg/$
$-\ $température de solidification ou de fusion : $t=0^{\circ}C$
$-\ $température d'ébullition ou de liquéfaction : $t=100^{\circ}C$
3. Corps purs simples et corps purs composés
3.1. Analyse de l'eau
3.1.1. Définition
Analyser un corps revient à chercher ses constituants par une méthode appropriée
3.1.2. L'électrolyse de l'eau
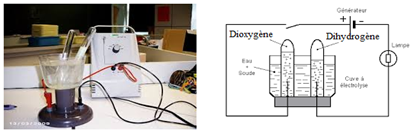
Mettons de l'eau additionnée de quelques gouttes d'acide dans le voltamètre (ou cuve à l'électrolyse) et fermons l'interrupteur
On constate que le courant circule et des dégagements gazeux au niveau des tubes
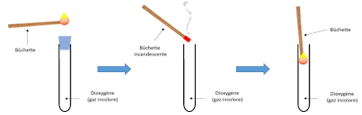
A l'anode $($signe$+)$, le gaz recueilli rallume une buchette presque éteinte.
Ce gaz est le dioxygène
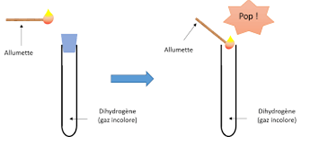
A la cathode $($signe$-)$, le gaz recueilli a volume deux fois grand et produit une légère détonation en présence d'une allumette enflammée.
Ce gaz est le dihydrogène
Conclusion :
$-\ $L'eau est décomposé par le courant électrique en dioxygène et en dihydrogène
$-\ $Le volume de dihydrogène est le double du volume de dioxygène :
$$V_{\text{dihydrogène}}=2V_{\text{dioxygène}}$$
$-\ $La masse total des gaz (dihydrogène et dioxygène) est égale à la d'eau disparue :
$m_{e}=m_{H}+m_{O}$
$$\begin{array}{lllll} \text{Eau}&\longrightarrow&\text{dioxygène}&+&\text{dihydrogène}\\ 18\,g& &16\,g& &2\,g \end{array}$$
Les masses de dihydrogène et de dioxygène sont proportionnelles à la masse d'eau disparue
$$\dfrac{m_{H}}{m_{E}}=\dfrac{2g}{18g}\Rightarrow\;m_{H}=\dfrac{1}{9}m_{E}$$
$$\dfrac{m_{O}}{m_{E}}=\dfrac{16g}{18g}\Rightarrow\;m_{o}=\dfrac{8}{9}m_{E}$$
$-\ $Un corps pur qui peut décomposer en deux ou plusieurs corps purs est un corps pur composé.
Exemple :
l'eau
$-\ $Un corps pur qui ne peut être décomposé en d'autres corps purs est un corps simple.
Exemples :
le dioxygène et le dihydrogène
3.2. Synthèse de l'eau
3.2.1. Définition
La synthèse de l'eau est la formation de l'eau à partir du mélange du dihydrogène et du dioxygène.
3.2.2. Synthèse eudiométrique

On déclenche des étincelles électriques au niveau des électrodes pour amorcer le processus
$-\ $La pression des gaz baisse, le niveau de mercure qui va remonter lorsque les deux gaz réagissent en formant une buée (eau) sur la paroi interne du tube eudiométrique

Commentaires
bara ndiaye (non vérifié)
lun, 10/16/2023 - 00:19
Permalien
cours
Ibrahima Sory D... (non vérifié)
dim, 11/26/2023 - 01:50
Permalien
Élève
Ibrahima Sory D... (non vérifié)
dim, 11/26/2023 - 01:50
Permalien
Élève
Fama sow (non vérifié)
dim, 11/16/2025 - 20:45
Permalien
Pc
Mareme gning (non vérifié)
mer, 01/03/2024 - 22:19
Permalien
Réussir
Mamadou (non vérifié)
ven, 11/22/2024 - 21:38
Permalien
Correction de devoir
Ndéye Coumba Sonko (non vérifié)
mer, 11/27/2024 - 19:35
Permalien
Exercice
Bassirou (non vérifié)
mer, 12/11/2024 - 16:53
Permalien
Apprendre
Ngoné kâ (non vérifié)
lun, 12/16/2024 - 19:32
Permalien
Des séries d'exercices SVP
Samoura_debondy (non vérifié)
lun, 10/13/2025 - 14:30
Permalien
Anticiper les matières
Djiby Diallo (non vérifié)
lun, 12/15/2025 - 20:31
Permalien
PC
Ajouter un commentaire