Les chaines carbonées insaturées : les alcènes et les alcynes - 1er L
Classe:
Première
Il existe, parmi les hydrocarbures un groupe de composé qui porte le nom d'hydrocarbures insaturés.
A égale nombre d'atomes de carbone, leur molécule contient moins d'atomes d'hydrogène que les molécules d'alcanes.
Ainsi, la formule de l'éthane étant $C_{2}H_{6}$ nous étudierons :
$\blacktriangleright\ $L'éthylène $C_{2}H_{4}$ (deux atomes d'hydrogène de moins) qui fait partie des alcènes.
$\blacktriangleright\ $L'acétylène ou l'éthyne $C_{2}H_{2}$ (atomes d'hydrogène de moins) qui fait partis des alcynes.
Ces hydrocarbures insaturés sont beaucoup plus réactifs que les alcanes.
En particulier ils se prêtent à un type de réaction : les réactions d'addition.
I. Structures des alcènes et des alcynes
1. Exemple d'alcène : l'éthylène ou l'éthène
L'éthylène ou l'éthène est le premier terme d'une série d'hydrocarbures insaturée appelée alcène.
L'éthène est gazeux dans les $CNTP$ et sa formule brute est $C_{2}H_{4}.$
Grâce aux méthodes physiques on a pu déterminer la géométrie de la molécule.
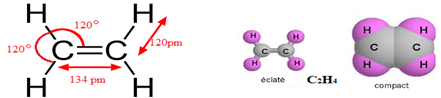
La plane est molécule, chaque atome se trouve dans un triangle, on dit que le carbone est trigonal $HCH=HCC=120^{\circ}$ et la double liaison $(C=C)$ a pour longueur $134\,pm.$
Les liaisons covalentes $(C=C)$ ne sont pas équivalentes.
Elles sont constituées de la liaison covalente $\sigma$ (sigma) solide et dure, et de la liaison covalente $\pi$ (pi) fragile.
2. Exemple d'alcyne : l’'acétylène ou éthyne
L'acétylène ou l'éthyne, le premier terme d'une série d'hydrocarbure insaturée appelée alcyne, est gazeux dans les $CNTP.$
Sa formule brute est $C_{2}H_{2}.$
Grâce aux méthodes des physiques on a pu déterminer la géométrie de la molécule.
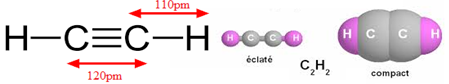
Chaque atome de carbone est lié à deux atomes par une simple liaison et une triple liaison.
On dit que l'atome de carbone est digonal.
La triple liaison possède deux liaisons $\pi$ (pi) fragiles et une liaison $\sigma$ (sigma) solide.
Les centres des atomes sont alignés, la molécule d'acétylène est linéaire.
Remarque
$d(C\equiv C)=120\,pm< d(C=C)=134\,pm< d(C-C)=154\,pm$
II. Nomenclature
1. Formules générales
Les alcènes sont des hydrocarbures insaturés à chaines ouvertes renfermant une double liaison.
Leur formule générale s'écrit : $C_{n}H_{2n}$ avec $n\geq 2.$
Les alcynes sont des hydrocarbures insaturés à chaine ouverte renfermant une triple liaison : leur formule générale s'écrit : $C_{n}H_{2n-2}$ avec $n\geq 2$
2. Règles de la Nomenclature
$\blacktriangleright\ $On utilise les mêmes règles de nomenclatures que les alcanes, mais la chaine principale est la chaine la plus longue comportant une liaison multiple.
$\blacktriangleright\ $La chaine est numérotée de telles sortes que les premiers atomes de carbone de la liaison multiple porte l'indice le plus petit.
$\blacktriangleright\ $L'indice sera placé entre le préfixe indiquant le nombre d'atomes de carbone de la chaine principale et le suffixe qui indique la nature du composé insaturé.
La terminaison « ane » est remplacée par « ène » pour les alcènes et « yne » pour les alcynes.

Commentaires
Diouf16890387hd... (non vérifié)
lun, 01/13/2025 - 21:35
Permalien
Pc
Ajouter un commentaire