Les alcanes - 1er s
Classe:
Première
Les hydrocarbures sont des composés organiques formés uniquement de carbone et d'hydrocarbure.
Leur formule générale s'écrit $C_{x}H_{y}.$
Les hydrocarbures les plus répandus et les plus importants au plan économique portent le nom d'alcanes ; constituants essentiels du gaz naturel et des pétroles.
I. Structures des alcanes
1. Rappel
$H$ : valence $1$ ;
$C$ : valence $4$
Une liaison covalente simple résulte la mise en commun entre deux atomes de deux électrons célibataires pour former un doublet d'électrons.
Pour satisfaire la règle de l'octet un atome de carbone doit engager ses quatre électrons célibataires dans des liaisons covalentes, on dit que l'atome de carbone est tétravalent.
L'atome d'hydrogène ne peut établir qu'une liaison de covalence, on dit que l'atome est monovalent.
2. Exemple du méthane : $CH_{4}$
2.1 Formule développée plane
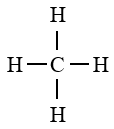
2.2 Structure de la molécule du méthane
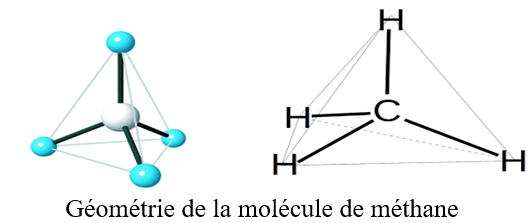
Les angles $HCH$ valent $109.28\,mn$ et les longueurs de liaison $CH$ valent $110\,pm$ $(pm$ (picometre)$=10^{-12}m.$
Les quatre atomes d'hydrogène sont disposés aux quatre sommets d'un tétraèdre au centre duquel se trouve l'atome de carbone.
La molécule du méthane est tétraédrique.
Autour du carbone il y a quatre liaisons de covalentes simples.
On dit que l'atome de carbone est tétragonal.
Les alcanes ne comportent que des carbones tétragonaux.
2.3 Représentation spatiale de la molécule
On adopte des conventions si après pour représenter en perspective une structure tridimensionnelle telle que l'atome de carbone tétraédrique soit dans le plan

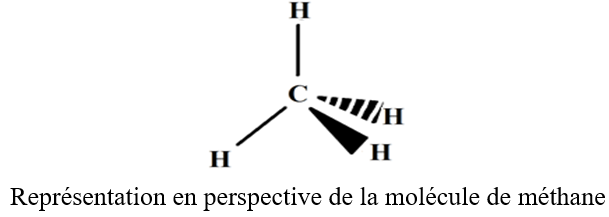
3. Exemple de l'éthane $C_{2}H_{6}$
3.1 Formule développée et semi-développée
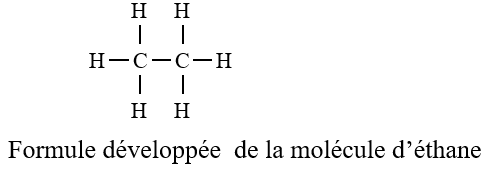

3.2 Géométrie de la molécule
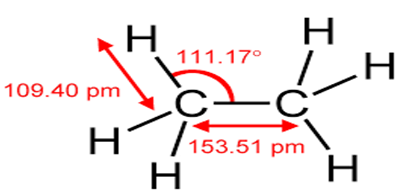
3.3 Représentation de Newman
La molécule est observée selon une liaison qui a été choisie.
Les atomes de la liaison considérée sont représentés par un cercle.
Les liaisons établies entre deux atomes et leur voisin sont projetés dans un plan perpendiculaire à la liaison choisie.
La libre rotation autour de la liaison carbone-carbone confère à la molécule une infinité de dispositions relatives des atomes d'hydrogène des deux groupes $CH_{3}$ (méthyle) Chacune de ces dispositions constitue une conformation.
Parmi l'infinité des conformations possibles, deux d'entre-elles possèdent une géométrie remarquable :
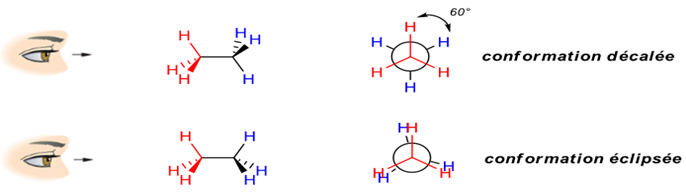
4. Généralisation la chaine des alcanes : isomérie de chaine
4.1 La chaine carbonée
A la formule brute $C_{4}H_{10}$ correspond deux formules développées et deux formules semi-développées.
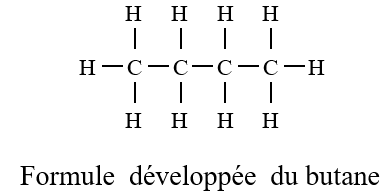
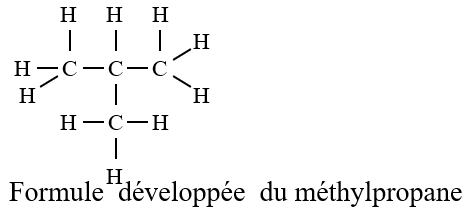
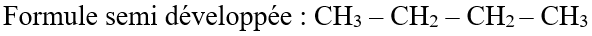
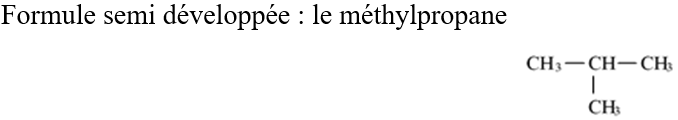
On voit donc apparaitre un enchainement d'atomes de carbone
On appelle chaîne carbonée ou squelette carboné l'enchaînement des atomes de carbone liés entre eux par des liaisons de covalence
Dans l'exemple a, la chaine carbonée est dite linéaire ou droite.
Les atomes de carbones du composé organique sont liés au plus à deux autres atomes de carbone
Dans l'exemple b, la chaine carbonée est dite ramifiée.
Une chaine carbonée est dite ramifiée si elle renferme au moins un atome de carbone lié lui-même à trois ou quatre atomes de carbone.
4.2 Isomérie de chaine
Les isomères de chaines sont des isomères de constitution qui diffèrent par l'enchainement des atomes de carbone.
Exemple :
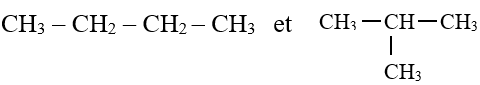
5. Le cas des Cyclanes
Il existe des hydrocarbures possédant des atomes carbone tétragonaux et dans lesquels toutes les liaisons carbonées sont de liaisons covalentes simples, mais dont la chaine carbonée est fermée.
On les appelle des cyclanes ou cycloalcanes répondant à la formule générale $C_{n}H_{2n}$ avec $n\geq 3.$
Exemples :
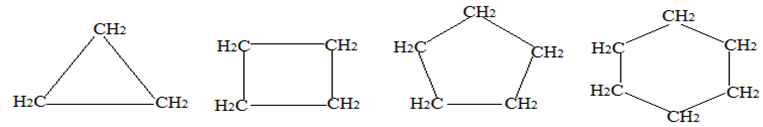
II. Nomenclature
Les alcanes sont des hydrocarbures saturés, acycliques, linéaires ou ramifiés de formule brute $C_{n}H_{2n+2}$ $($où $n$ entier$).$
1. Alcane à chaine linéaire ou droite
Une chaine est linéaire ou droite si les atomes de carbone du composé organique sont liés au plus à deux autres atomes de carbone.
Exemple :
$CH_{3}-CH_{2}-CH_{2}-CH_{2}-CH_{3}$
Le nom d'un alcane à chaine linéaire est formé à partir :
$-\ $ d'un préfixe qui indique le nombre d'atomes de carbone (voir tableau)
$-\ $ d'un suffixe : $–$ ane
Exemples
$$\begin{array}{|c|c|c|c|c|c|c|c|}\hline 3&4&5&6&7&8&9&10\\ \hline \text{prop}&\text{but}&\text{pent}&\text{hex}&\text{hept}&\text{oct}&\text{non}&\text{déc}\\ \hline \text{Propane}&\text{Butane}&\text{Pentane}&\text{Hexane}&\text{Heptane}&\text{Octane}&\text{Nonane}&\text{Décane}\\ \hline C_{3}H_{8}&C_{4}H_{10}&C_{5}H_{12}&C_{6}H_{14}&C_{7}H_{16}&C_{8}H_{18}&C_{9}H_{20}&C_{10}H_{22}\\ \hline \end{array}$$
$$\begin{array}{|c|c|c|c|} \hline \text{formule brute}&\text{nom}&\text{formule brute}&\text{nom}\\ \hline C_{11}H_{24}&\text{undécane}&\ldots&\\ \hline C_{12}H_{26}&\text{dodécane}&C_{29}H_{60}&\text{nonacosane}\\ \hline C_{13}H_{28}&\text{tridécane}&C_{30}H_{62}&\text{triacontane}\\ \hline C_{14}H_{30}&\text{tétradécane}&C_{40}H_{82}&\text{tétracontane}\\ \hline C_{15}H_{32}&\text{pentadécane}&C_{50}H_{102}&\text{pentacontane}\\ \hline \ldots& &C_{60}H_{122}&\text{hexacontane}\\ \hline C_{20}H_{42}&\text{eicosane}&C_{70}H_{142}&\text{heptacontane}\\ \hline C_{21}H_{44}&\text{heneicosane}&C_{80}H_{162}&\text{octacontane}\\ \hline C_{23}H_{48}&\text{tricosane}&C_{100}H_{202}&\text{hectane}\\ \hline \end{array}$$
Remarque :
Les quatre premiers ont un nom consacré par l'usage.
Il s'agit du méthane, de l'éthane, du propane et du butane.
A partir du pentane le préfixe d'origine grecque indique le nombre d'atome de carbone dans la molécule.
2. Groupes alkyles non ramifiées
En retirant un atome d'hydrogène à un carbone terminal d'un alcane linéaire, il apparait un groupe alkyle $\left(C_{n}H_{2n+1^{-}}\right)$ dont le nom s'obtient en remplaçant la terminaison $« ane »$ par $« yle ».$
Exemples :
$$\begin{array}{|c|c|c|c|c|} \hline \text{Nombre d'atomes}&\text{Nom de l'alcane}&\text{Formule brute}&\text{Nom du groupement alkyle}&\text{Formule}\\ \text{de carbone}& & &\text{Méthyl}&\\ \hline 1&\text{Méthane}&CH_{4}&\text{Méthyl}&CH_{3^{-}}\\ \hline 2&\text{Ethane}&C_{2}H_{6}&\text{Ethyl}&C_{2}H_{5^{-}}\\ \hline 3&\text{Propane}&C_{3}H_{8}&\text{Propyl}&C_{3}H_{7^{-}}\\ \hline 4&\text{Butane}&C_{4}H_{10}&\text{Butyl}&C_{4}H_{9^{-}}\\ \hline 5&\text{Pentane}&C_{5}H_{12}&\text{Pentyl}&C_{5}H_{11^{-}}\\ \hline 6&\text{Hexane}&C_{6}H_{14}&\text{Hexyl}&C_{6}H_{13^{-}}\\ \hline 7&\text{Heptane}&C_{7}H_{16}&\text{Heptyl}&C_{7}H_{15^{-}}\\ \hline 8&\text{Octane}&C_{8}H_{18}&\text{Octyl}&C_{8}H_{17^{-}}\\ \hline 9&\text{Nonane}&C_{9}H_{20}&\text{Nonyl}&C_{9}H_{19^{-}}\\ \hline 10&\text{Décane}&C_{10}H_{22}&\text{Décyl}&C_{10}H_{21^{-}}\\ \hline \end{array}$$
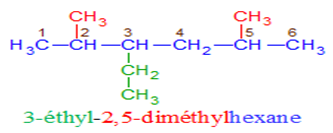
3. Alcanes à chaine linéaire ramifiée
Une chaine carbonée est en générale ramifiée si elle renferme au moins un atome de carbone lié lui-même à trois ou quatre autres atomes de carbone.
Exemple :
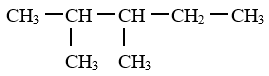
$\surd\ $ Nomenclature
$-\ $ La chaine carbonée la plus longue est appelée chaine principale.
Son nombre de carbones détermine le nom de l'alcane.
$-\ $ On numérote la chaine principale de façon à ce que le numéro du premier atome de carbone portant une ramification soit le plus petit possible.
$-\ $ Le nom de l'alcane ramifié est constitué des noms de ramification alkyle précédé de leur indice de position et suivie du nom de l'alcane linéaire de même chaine principale.
$-\ $ Dans le cas des substituants identiques, on utilise les préfixes di, tri, tétra...
Les substituants sont nommés dans l'ordre alphabétique ; cet ordre ne prend pas en compte les préfixes di, tri, tétra...
Exemples :
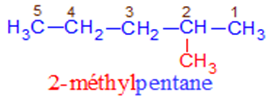
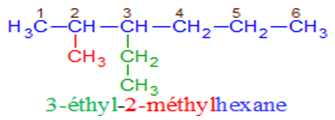
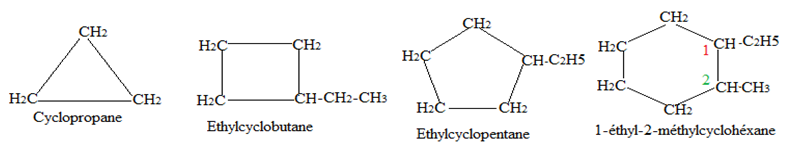
4. Les cyclanes
4.1 Définition
Les cyclanes sont des hydrocarbures saturés à chaines carbonées cycliques.
La formule générale d'un cyclane comportant un cycle est $C_{n}H_{2n}$ avec $n\geq 3.$
4.2 Nomenclature
Pour nommer un cyclane, on utilisé le nom de l'alcane possédant le même nombre d'atomes de carbone précédé du préfixe $« cyclo ».$
Exemples :
III. Les propriétés des alcanes
1. Propriétés physiques
Dans les conditions ordinaires de température et de pression les alcanes à chaines linéaires sont :
$-\ $ gazeux pour les quatre premiers de la série : $C_{1}$ à $C_{4}$ : méthane, éthane, propane et le butane
$-\ $ liquides de $C_{5}H_{12}$ à $C_{15}H_{32}$
$-\ $ solides à partir de $C_{16}H_{34}.$
Un alcane à chaine ramifiée a une température d'ébullition inférieure à celle d'un alcane linéaire possédant le même nombre d'atomes de carbones.
La température d'ébullition est d'autant plus basse que la chaine est ramifiée.
Tous les alcanes sont insolubles dans l'eau.
Ils sont solubles les uns dans les autres. Dans les pétroles, les alcanes solides et gazeux sont en solution dans les alcanes liquides.
Les alcanes liquides sont moins denses que l'eau.
2. Propriétés chimique
2.1 Réaction de destruction
2.1.1 Combustion complète dans le dioxygène
Exemple du méthane :
La combustion complète du méthane produit de la vapeur d'eau et du dioxyde de carbone
Cette combustion exothermique avec production de l'énergie thermique et $890KJ/mol$ de méthane.
L'équation bilan de la réaction s'écrit :
$CH_{4}\ +\ 2O_{2}\ \rightarrow\ CO_{2}\ +\ 2H_{2}O$
$C_{n}H_{2n+2}\ +\ \dfrac{3n+1}{2}O_{2}\ \rightarrow\ nCO_{2}\ +\ (n+1)H_{2}O$
$\surd\ $ Intérêt pratique des combustions
La combustion des alcanes a des applications d'importances considérables : en effet les alcanes sont utilisés comme combustible de chauffage et comme carburants.
Ils sont donc des ressources de l'énergie thermique maïs aussi des sources de l'énergie mécanique (transformation de l'énergie thermique en l'énergie mécanique dans les moteurs) et sources de l'énergie électrique.
Remarque
Lorsque la quantité de dioxygène est insuffisante, la combustion est incomplète et il peut se former, en plus du dioxyde de carbone et de l'eau, du monoxyde de carbone et du carbone
2.1.2 Combustion des alcanes dans le dichlore
La combustion des alcanes peut être interprétée comme une destruction de leurs molécules dans le dioxygène.
Cela est possible avec le dichlore sous l'action de la flamme avec le méthane par exemple.
$$CH_{4}\ +\ 2Cl_{2}\ \rightarrow\ C\ +\ 4HCl$$
On obtient du chlorure d'hydrogène et du carbone divisé.
2.2 Réaction de substitution
Une réaction de substitution est une réaction au cours de laquelle des atomes sont remplacés par d'autres atomes.
La réaction nécessite de la lumière : c'est une réaction photo chimique.
2.2.1 Chloration du méthane
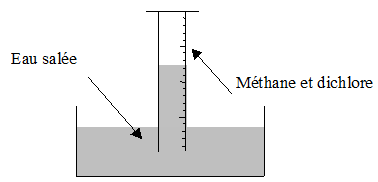
En présence de lumière, le méthane réagit avec le dichlore.
La couleur verdâtre du mélange disparaît peu à peu, le niveau d'eau monte et des gouttelettes huileuses apparaissent sur les parois de l'éprouvette.
C'est du chlorométhane obtenu par réaction photochimique.
Les atomes d'hydrogène ont été remplacés successivement par des atomes de chlore.
$CH_{4}\ +\ Cl_{2}\ \rightarrow\ CH_{3}Cl\ +\ HCl$ Chlorométhane
$CH_{3}Cl\ +\ Cl_{2}\ \rightarrow\ CH_{2}Cl_{2}\ +\ HCl$ Dichloromethane
$CH_{2}Cl_{2}\ +\ Cl_{2}\ \rightarrow\ CHCl_{3}\ +\ HCl$ Trichlorométhane (Chloroforme)
$CHCl_{3}\ +\ Cl_{2}\ \rightarrow\ CCl_{4}\ +\ HCl$ Tétrachlorométhane
Les atomes de chlore se sont substitués aux atomes de carbone, d'où le nom de réaction de substitution.
2.2.2 Brommation de l'heptane
On obtient à la fin de la réaction des dérives bromés.
$C_{7}H_{16}\ +\ Br_{2}\ \rightarrow\ C_{7}H_{15}Br\ +\ HBr$
$C_{7}H_{15}Br\ +\ Br_{2}\ \rightarrow\ C_{7}H_{14}Br_{2}\ +\ HBr$
$C_{7}H_{14}Br_{2}\ +\ Br_{2}\ \rightarrow\ C_{7}H_{13}Br_{3}\ +\ HBr$
Remarque
Il existe des dérivés iodés et fluorés des alcanes ; mais ils ne peuvent pas être obtenus par des réactions de substitution sur les alcanes.
L'action du dichlore et du dibrome sur un alcane fournit en généraleun mélange de plusieurs dérivés mono substitués et disubstitués.

Commentaires
Ndiaye (non vérifié)
ven, 01/29/2021 - 13:43
Permalien
Appréciation
omar sene (non vérifié)
lun, 03/01/2021 - 15:19
Permalien
Merci beaucoup
Sangare (non vérifié)
ven, 10/22/2021 - 20:09
Permalien
Télécharger des cours
Anonyme (non vérifié)
mer, 03/09/2022 - 04:41
Permalien
Vjcjj
Anonyme (non vérifié)
mer, 03/09/2022 - 04:41
Permalien
Vjcjj
yvan (non vérifié)
sam, 10/08/2022 - 21:40
Permalien
merci beaucoup
Lamine drame (non vérifié)
ven, 11/04/2022 - 11:04
Permalien
Télécharger
Lamine drame (non vérifié)
ven, 11/04/2022 - 11:06
Permalien
Télécharger
Anonyme (non vérifié)
jeu, 11/30/2023 - 00:37
Permalien
Utile
Anonyme (non vérifié)
ven, 12/01/2023 - 00:28
Permalien
Bien
Neo cours (non vérifié)
dim, 03/31/2024 - 12:16
Permalien
Super, je vais m'en servir
Ajouter un commentaire