Série d'exercices : Classification qualitative des couples oxydant - réducteur ion /métal - 1er s
Classe:
Première
Exercice 1
Une lame de fer plongée dans une solution de sulfate de cuivre $\left(Cu^{2+}\;,\ SO_{4}^{2+}\right)$ se recouvre d'un dépôt de cuivre.
Une lame de cuivre plongée dans une solution de nitrate d'argent $\left(Ag^{+}\;,\ NO^{3-}\right)$ se recouvre d'un dépôt d'argent.
1) Écrire dans chaque cas, l'équation de la réaction qui se produit.
2) Préciser les couples redox mis en jeu.
3) Classer les métaux mis en jeu par pouvoir réducteur croissant.
4) L'hydrogène est moins réducteur que le fer.
Dire ce qui se passe si on met du fer dans une solution acide.
Exercice 2
On veut étudier le couple $Co^{2+}/Co$ ($Co$ est le cobalt).
On réalise deux expériences.
Expérience a :
$100\,ml$ d'une solution rose contenant des ions cobalt, de concentration $0.20\,mol\cdot L^{-1}$ sont décolorés par le métal fer et il se forme un dépôt sur le fer
Expérience b :
Le cobalt métallique donne un dégagement de dihydrogène en milieu acide.
1) Expliquer ce qui s'est passé dans les deux expériences ; écrire les équations-bilan des réactions
2) Classer qualitativement les trois couples mis en jeu.
3) Dans la première expérience quelle est la masse de métal formé ?
Exercice 3
On réalise les expériences suivantes :
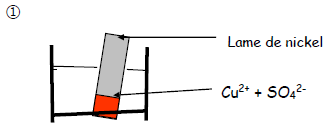
On observe un dépôt de cuivre sur la partie immergée de la lame de nickel
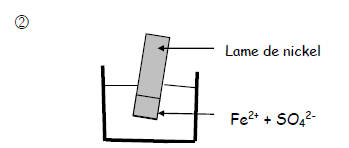
Aucun dépôt n'est observé sur la partie immergée de la lame de nickel
1) Écrire la demi-équation du couple rédox qui permet d'expliquer le dépôt de cuivre.
2) Écrire la demi-équation du couple rédox qui permet d'où proviennent les électrons de la demi-réaction précédente.
3) Écrire l'équation bilan de la réaction chimique traduisant le dépôt métallique.
Expliquer pourquoi aucun dépôt n'est observé dans l'expérience 2
Exercice 4
I. On plonge une lame de zinc $Zn$ dans une solution bleue contenant des ions cuivre $(II)$ $Cu^{2+}.$
Quelques minutes après on observe un dépôt rougeâtre sur la lame de zinc.
1) Préciser la nature de ce dépôt.
2) Écrire les demi équations électroniques représentant les transformations subies par l'ion $Cu^{2+}$ et le zinc $Zn.$
3) Écrire l'équation bilan de la réaction d'oxydo réduction.
4) Préciser l'oxydant et le réducteur qui interviennent dans cette réaction.
5) La corrosion est un phénomène bien connu des marins.
Les bateaux dont la coque est en acier en sont victimes et doivent en être protégés.
Une méthode de protection consiste à poser à la surface de la coque des blocs de métal que l'on appelle « anodes sacrificielles ».
Pour prévoir les réactions d'oxydoréduction, on peut s'appuyer sur l'échelle de classification électrochimique suivante
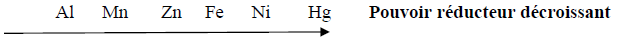
a) Citer les métaux qui peuvent jouer le rôle de « anode sacrificielle ».
Justifier la réponse.
b) Écrire l'équation bilan de la réaction avec l'une des métaux possible.
II. On dispose de $1\,g$ d'un alliage de cuivre et de zinc dont on ne connait pas la composition.
Le cuivre ne réagit pas avec les ions $H_{3}O^{+}$ par contre le zinc réagit .
On attaque donc cet alliage avec l'acide chlorhydrique
$\left(H_{3}O^{+}\ ;\ Cl^{-}\right)$ en excès, on obtient un dégagement gazeux de dihydrogène $H_{2}$ dont on mesure le volume $V=0.14\,L.$
1) Sachant que les couples oxydant/réducteur sont $Zn^{2+}/Zn$ ; $H_{3}O^{+}/H_{2}$
Écrire les demi-équations électroniques et l'équation bilan de la réaction.
2) a) Calculer la quantité de matière (nombre de moles) de dihydrogène obtenu.
On donne le volume molaire $V_{m}=22.4\,L\cdot mol^{-1}$
b) Déterminer la masse de zinc ayant réagit $M(Zn)=65.4\,g\cdot mol^{-1}$
3) Déterminer la masse de cuivre contenu dans cet alliage
On classe les quatre métaux : Cuivre, Fer, Zinc et Aluminium par ordre croissant du pouvoir réducteur :
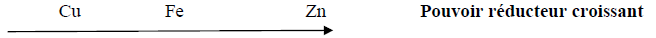
1) Écrire les équations des réactions d'oxydoréductions qui se produisent s'il est possible, en justifiant votre réponse quand on plonge :
a) Une lame de fer dans une solution contenant des ions $Au^{3+}$
b) Une lame de zinc dans une solution contenant des ions $Cu^{2+}$
2) L'acide chlorhydrique $\left(H_{3}O^{+}\right)$ réagit sur le fer en donnant un dégagement de dihydrogène ; une lame de cuivre ne réagit pas avec l'acide chlorhydrique.
Placer le dihydrogène sur l'axe de classification électrochimique ci-dessus.
Exercice 5
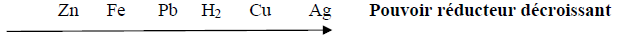
On introduit $1.12\,g$ de fer en poudre dans $100\,mL$ d'une solution aqueuse de sulfate de cuivre $\left(CuSO_{4}\right)$ de molarité égale à $0.2\,mol\cdot L^{-1}.$
1) Écrire l'équation de la réaction qui a lieu.
2) En supposant que la réaction est totale, calculer
a) la masse du solide formé.
b) la concentration des ions $Fe^{2+}$ dans la solution.
3) On filtre le mélange obtenu.
On ajoute à $50\,mL$ du filtrat $5\,g$ d'un mélange de poudre de zinc, de plomb et d'argent
a) Quelle est la réaction qui se produit ?
b) Écrire les deux demi-équations électroniques et l'équation bilan de la réaction qui se produit.
c) En supposant que la rection est totale et que les réactifs sont pris dans les proportions stoechiométriques, calculer la quantité de matière du métal formé.
En déduire la masse du métal attaqué.
4) On filtre le nouveau mélange.
On verse sur le résidu une solution d'acide chlorhydrique en excès.
On recueille $0.672\,L$ de dihydrogène.
a) Montrer qu'il se produit deux réactions d'oxydoréduction.
b) Préciser les deux couples rédox pour chaque réaction.
c) Écrire les demi équations électroniques, en déduire les équations bilan de deux réactions.
d) Calculer la masse de chaque métal du mélange (zinc, plomb et argent).
On donne :
$M_{Cu}=64\,g\cdot mol^{-1}$ ; $M_{Fe}=56\,g\cdot mol^{-1}$ ; $M_{Zn}=65.3\,g\cdot mol^{-1}$ ; $M_{Pb}=207\,g\cdot mol^{-1}$ ; $V_{M}=24\,L\cdot mol^{-1}$
Exercice 6
Le laiton est un alliage formé de deux métaux le cuivre et le zinc.
On fait réagir un échantillon de 15 g de cet alliage sur une solution d'acide chlorhydrique en large excès.
Il se dégage un volume $V=0.9\,L$ de dihydrogène mesuré dans les conditions normales de température et de pression.
En ajoutant au filtrat, une solution d'hydroxyde de sodium , il se forme un précipité.
1) En se basant sur l'échelle de la classification électrochimique des métaux, montrer que seul le zinc a réagit.
2) Écrire l'équation de la réaction entre le zinc $Zn$ et les ions $H_{3}O^{+}.$
Préciser les couples rédox mis en jeu au cours de cette réaction d'oxydoréduction.
3) a) Calculer la quantité de matière de dihydrogène recueillie à la fin de la réaction.
b) En déduire la quantité de matière de zinc contenue dans l'échantillon.
4) a) Calculer la masse du zinc qui a réagi.
b) En déduire le pourcentage massique, en zinc et en cuivre, du laiton.
On donne :
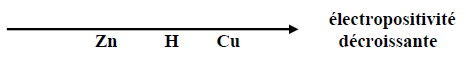
$V_{m}=22.4\,L\cdot mol^{-1}\text{ et }M_{Zn}=65.4\,g\cdot mol^{-1}$
Exercice 7
Soit la classification des éléments chimiques par ordre de pouvoir réducteur croissant.

1) Décrire qu'est ce que se passe dans chaque expérience.
a) On plonge une lame de cuivre dans une solution $\left(Ag^{+}\;,\ NO_{3}^{-}\right)$
b) On plonge une lame de cuivre dans une solution $\left(Zn^{2+}\;,\ SO_{4}^{2-}\right)$
c) Si on plonge une lame d'Aluminium dans une solution $\left(H^{+}\;,\ Cl^{-}\right)$
2) Donner l'équation de la réaction lorsqu'il est possible
Exercice 8
On donne les masses molaires en $(g\cdot mol^{-1})$ de : $Fe=56$ et $Ag=108$
Dans un volume $V=100\,cm^{3}$ d'une solution aqueuse de nitrate d'argent $\left((Ag^{+}+NO_{3}^{-}\right)$ de concentration molaire $C=1\,mol\cdot L^{-1}$, on ajoute une masse $m=2.24\,g$ de fer en poudre, on constate qu'un dépôt gris scintillant apparaît sur les grains de fer.
Lorsque la réaction atteint son état final on ajoute aux produits formés quelques gouttes d'une solution d'hydroxyde de sodium, on remarque qu'un précipité vert apparaît instantanément.
1) a) Identifier les produits de la réaction.
Justifier la réponse.
b) Écrire les équations relatives à l'oxydation et à la réduction.
$-\ $ En déduire l'équation bilan de la réaction.
$-\ $ Préciser les couples rédox mis en jeu au cours de cette réaction.
2) a) Calculer la quantité de matière initiale de chacun des réactifs.
b) Les réactifs sont-ils en proportions stœchiométriques ?
Si non, quel est le réactif limitant ?
c) Calculer, à la fin de la réaction,
$-\ $ la concentration molaire des ions présents dans la solution.
$-\ $ la masse du dépôt métallique formé.
3) Sachant qu'une solution d'acide chlorhydrique réagit avec le fer mais elle est sans action sur l'argent.
Comparer en justifiant la réponse les pouvoirs réducteurs de $Fe$, $Ag$, $H.$
Les placer sur un axe par ordre de pouvoir réducteur croissant
Exercice 9
On dissout du nitrate de cuivre $II$ $Cu\left(N0_{3}\right)_{2}$, du nitrate d'argent $AgN0_{3}$ et du nitrate d'or $Au\left(NO_{3}\right)_{3}$ dans de l'eau pure de façon à obtenir $300\,ml$ d'une solution $(S).$
On partage ensuite $(S)$ en trois parties égales.
Dans la première partie $(S_{1})$ on place une lame d'argent, on obtient un dépôt d'or de masse $m_{1}=0.394\,g.$
Dans la deuxième partie $(S_{2})$, on met une lame de cuivre, On obtient un dépôt d'argent et d'or de masse $m_{2}=0.934\,g.$
Dans la troisième partie $(S_{3})$, on place une lame de zinc on obtient un dépôt d'argent d'or et de cuivre de masse $m_{3}=1.188\,g.$
l) a) interpréter ces expériences.
b) Écrire les équations des réactions dans $(S_{1})$ et $(S_{2})$, en précisant à chaque fois l'oxydant et le réducteur
c) Déduire une classification électrochimique des métaux utilisés.
2) Calculer les molarités des ions $Cu^{2+}$, $Ag^{+}$, $Au^{3+}$ et $NO_{3}^{-}$ dans la solution $(S).$
On donne :
$Ag=108\,g\cdot mol^{-1}\;,\ Au=197\,g\cdot mol^{-1}\;,\ Cu=63.5\,g\cdot mol^{-1}\;,\ Zn=65\,g\cdot mol^{-1}$

Commentaires
Anonyme (non vérifié)
ven, 12/11/2020 - 02:02
Permalien
Pourrais je avoir le corrigé
Anthony (non vérifié)
mar, 12/29/2020 - 17:27
Permalien
Chimie
Anonyme (non vérifié)
ven, 12/11/2020 - 02:02
Permalien
Pourrais je avoir le corrigé
Anonyme (non vérifié)
ven, 12/11/2020 - 02:02
Permalien
Pourrais je avoir le corrigé
Tolo (non vérifié)
ven, 12/10/2021 - 17:45
Permalien
Corrigé
Frais (non vérifié)
mer, 03/16/2022 - 10:34
Permalien
Prof
saam (non vérifié)
mar, 06/07/2022 - 12:22
Permalien
ds
Yao serge (non vérifié)
lun, 03/04/2024 - 20:06
Permalien
Avoir un bonne connaissance en physique chimie
Ajouter un commentaire