Série d'exercices : Les composés oxygénés - 1er s
Classe:
Première
Exercice 1
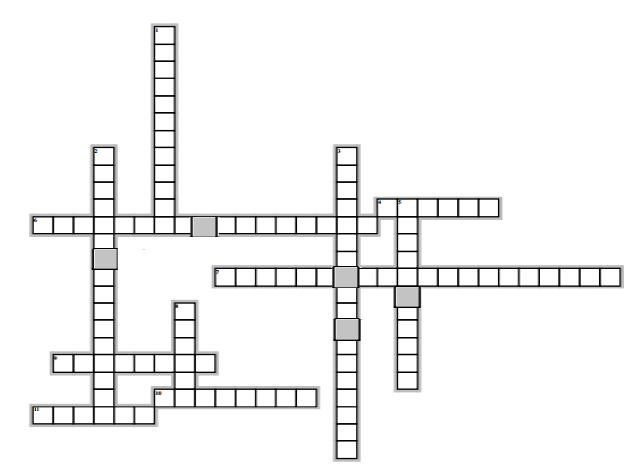
Horizontalement
4) Son nom se termine par le suffixe one
6) Corps organiques qui renferment les éléments : carbone, hydrogène et oxygène
7) Composés oxygénés renferment le groupe carbonyle
9) ensemble de caractères chimiques associés à la présence dans une molécule d'un atome ou groupe d'atomes
10) Composé organique faisant partie de la famille des composés carbonylés
11) Composés oxygènes renfermant deux atomes d'oxygène et donnant un test négatif avec le $B.B.T$
Verticalement
1) Elle permet d'identifier la fonction et le nom du composé organique
2) Il caractérisé les aldéhydes et cétones
3) Test propre aux aldéhydes
5) Isomère de fonction de l'alcool
8) Nom générique des composés oxygénés dérivant des alcanes, contenant un groupement hydroxyle
Exercice 2
1) Compléter le tableau suivant :
$$\begin{array}{|c|c|c|} \hline \text{Fonction}&\text{Groupe caractéristique}&\text{Nom du groupe caractéristique}\\ \hline \text{Cétone}& &\\ \hline &-COOH&\\ \hline \text{Alcool}& &\\ \hline &-CHO&\\ \hline \text{Ester}& &\\ \hline \end{array}$$
2) Nommer les composés suivants.
(Si c'est un alcool, préciser sa classe).
$CH_{3}-CHOH-CH_{2}-CH_{3}$
$CH_{3}-CH_{2}-CHO$
$CH_{3}-CH_{2}-COH-CH_{2}-CH_{3}$
$CH_{2}$
$CH_{3}$
$CH_{3}-CO-CH_{2}-CH_{3}$
$CH_{3}-CH_{2}-CH-COOH$
$CH_{3}$
$CH_{3}-CH_{2}-CH_{2}-CH_{2}-CO-O-CH_{2}-CH_{3}$
Exercice 3
1) Quel groupe caractérise un alcool ?
Un aldéhyde ?
Une cétone ?
2) Écrire la formules semi-développé de chacun des corps suivants en indiquant à quel groupe fonctionnel ils appartiennent
a) Méthanol
b) Butanone
c) Acide propanoique
d) Butanoate de méthyle
e) Butanal
f) Pentan$-2-$ol
g) $-2-$méthylpropan$-2-$ol
h) Acide$-2-$méthylpropanoique
i) Pentan$-3-$on
j) Butanoate d'éthyle
3) A quelle famille de composés organiques appartiennent les molécules suivantes (donner leur nom) :
$CH_{3}-CH_{2}-CH_{2}-CH_{2}-CH_{2}-CH_{2}-CHOH-CH_{3}$
$CH_{3}-CH_{2}-CH_{2}-CH_{2}-COOH-CH_{3}$
$CH_{3}-CH_{2}-CO-CH_{2}-CH_{2}-CH_{3}$
$CH_{2}-COH\left(CH_{3}\right)-CH_{3}$
$CH_{3}-CH_{2}-CH_{2}-CH\left(C_{2}H_{5}\right)-CO-CH_{3}$
$CH_{3}-CH_{2}-CH_{2}-CH\left(C{2}H_{5}\right)-CH_{2}OH$
$CH_{2}-CH\left(C{2}H_{5}\right)-CHO$
Exercice 4 : Étiquetage imprécis
La composition d'un liquide lave-glace mentionne la présence en proportion importante d'un composé $A$ de formule $C_{3}H_{8}O.$
Afin de lever le doute sur l'imprécision apportée par cette seule formule brute, le professeur propose à ses élèves de réaliser deux expériences :
$-\ $ oxydation ménagée de quelques $mL$ de liquide $A$ avec oxydant en défaut ;
$-\ $ analyse des produits de l'oxydation ménagée de $A.$
Le test avec la $2.4-DNPH$ est positif, mais celui avec la liqueur de Felhing est négatif.
1) Montrer que la formule brute $C_{3}H_{8}O$ conduit à deux formules semi-développées.
2) Nommer les deux isomères.
Quel est leur groupe caractéristique ?
Préciser leur classe.
3) Quel groupe caractéristique est mis en évidence dans les produits de l'oxydation de $A$ ?
Justifier votre réponse.
4) Conclure sur la formule semi-développée du composé $A.$
Justifier.
5) On déshydrate $A.$
Nommer le composé obtenu et écrire l'équation bilan de la réaction.
Exercice 5 Identification de composés oxygénés
On dispose de cinq flacons contenant des liquides inconnus $A$, $B$, $C$, $D$ et $E$, tous différents mais de formule brute $C_{3}H_{x}O_{y}.$
Chaque composé ne présente qu'un seul groupe caractéristique oxygéné.
Les chaînes carbonées de ces composés ne contiennent ni double liaison, ni cycle.
Parmi les cinq composés, deux sont des alcools.
L'oxydation de $A$ conduit à $C$ ou $D$ ; celle de $B$ conduit à $E.$
1) Ces données sont-elles suffisantes pour identifier les cinq composés ?
2) Le composé $C$ réagit avec la liqueur de Fehling, contrairement à $D.$
En déduire la formule semi-développée et le nom de ces cinq composés.
Exercice 6 : Pourcentage massique et formule d'alcools
On appelle pourcentage massique $P$ d'un élément dans une molécule, le quotient de la masse de cet élément dans une mole de molécules par la masse molaire de la molécule.
On considère un alcool $A$ qui a la même chaîne carbonée qu'un alcane comportant $n$ atomes de carbone.
1. Exprimer la formule brute de l'alcool en fonction de $n.$
2. En déduire l'expression de la masse molaire de $A$ en fonction de $n.$
3. Le pourcentage massique de l'élément oxygène dans la molécule $A$ est $P(O)=26.7\%.$
3.1 Déterminer la valeur de $n$ et la formule brute de $A.$
En déduire les formules semi-développées possibles pour $A.$
Identifier $A$ sachant que c'est un alcool primaire.
Exercice 7
L'analyse élémentaire d'un composé organique formé seulement de carbone, d'hydrogène et d'oxygène a montré qu'il contient $60\%$ en masse de carbone et $13.3\%$ d'hydrogène.
Sa masse molaire moléculaire est $M=60\,g\cdot mol^{-1}.$
1. Déterminer sa formule brute.
2. On réalise la combustion complète d'une masse $m=1.2\,g$ de ce composé.
2.1 Écrire l'équation de la réaction.
2.2 Calculer la masse de carbone et d'hydrogène dans cet échantillon.
2.3 En déduire la masse d'eau et le volume de dioxyde de carbone obtenus quand la réaction est terminée.
3. Donner les formules semi développées possibles de ce composé.
Donnée :
$Mc=12\,g\cdot mol^{-1}$ ;
$Mo=16\,g\cdot mol^{-1}$ ;
$MH=1\,g\cdot mol^{-1}$ ;
$Vm=24\,L\cdot mol^{-1}$
Exercice 8
Deux alcools aliphatiques saturés isomères $(A_{1})$ et $(A_{2})$ ont une même masse molaire $M=74\,g\cdot mol^{-1}$
1. Montrer que leur formule brute est $C_{4}H_{10}O.$
2. On réalise leur oxydation ménagée par une solution de bichromate de potassium acidifiée.
$A_{1}$ ne donne rien
$A_{2}$ donne un composé $B_{2}$
$B_{2}$ donne un test positif avec la $D.N.P.H$ et un test négatif avec le réactif de Schiff.
2.1 Préciser en le justifiant la classe de chacun des alcools $(A_{1})$ et $A.$
2.2 Donner la formule semi développées et le nom de $B_{2}.$
2.3 Donner la formule semi développées et le nom de $A_{1}$ et $A_{2}$
3. On réalise la déshydratation intramoléculaire de $A_{1}$ en présence de l'acide sulfurique.
On obtient un composé organique $C_{1}.$
3.1 Écrire l'équation de la réaction en utilisant les formules semis développées.
3.2 Préciser le nom de $C_{1}$ et dire, comment on peut l'identifier ?
Exercice 9
La combustion complète, par le dioxygène, de $0.1\,mol$ d'un alcool saturé $A$ :
$C_{n}H_{2n+2}O$ a entraîné la formation de $6.72\,L$ de dioxyde de carbone, mesuré dans les conditions normales.
1. a) Écrire l'équation de combustion.
En déduire la formule brute de cet alcool.
b) Donner la formule semi-développée et le nom de chacun des isomères possibles.
2. On dispose de deux réactifs :
$-\ $ une solution de $D.N.P.H$ ;
$-\ $ une solution de liqueur de Fehling.
a) Que permettent de tester ces réactifs ?
b) Ayant isolé entité chimique provenant de l'oxydation ménagée de $A$, peut-on, en utilisant ces réactifs, identifier sans ambiguïté l'alcool $A$ ?
3. a) L'alcool $A$ a été obtenu par hydratation d'un alcène.
Lequel ?
b) Préciser si cette hydratation conduit à un ou plusieurs des isomères trouvés à la question 1.
Donner les équations chimiques de cette hydratation.
On donne : $V_{0}=22.4\,L$ (volume molaire dans les conditions normales)
Exercice 10
1. On prépare un alcool $A$ par addition d'eau sur un alcène $B$ de formule brute $C_{n}H_{2n}.$
Écrire l'équation de la réaction.
2. La combustion complète de $m\,(g)$ de $A$ donne une masse $m_{1}\,(g)$ de dioxyde de carbone et une $m_{2}\,(g)$ d'eau telles que :
$\dfrac{m_{1}}{m_{2}}=\dfrac{11}{6}$
2.1 Écrire l'équation de la réaction de combustion de $A.$
2.2 En déduire la valeur de $n$ et les formules brutes de $A$ et $B.$
2.3 Écrire les formules semi-développées de $A$ et $B.$
3. Par oxydation ménagée de $A$ on obtient un composé $A'.$
On fait réagir une masse $m$ de $A'$ sur la liqueur de Fehling.
Après chauffage on obtient un précipité rouge brique de masse molaire $143\,g\cdot mol^{-1}$ qu'on recueille, sèche et pèse.
3. Nommer les produits $A$ et $A'.$
Exercice 11
On considère un monoalcool aliphatique saturé de masse molaire moléculaire $M=74\,g\cdot mol^{-1}.$
1) Déterminer la formule brute de cet alcool.
2) Donner la formule semi-développée, le nom et la classe de chacun des alcools isomères correspondant à cette formule brute.
3) On désire identifier trois de ces isomères désignées respectivement par $A$, $B$ et $C.$
Pour cela, on les soumet à une oxydation ménagée par une solution acidifiée de permanganate de potassium.
Les résultats observés sont répertoriés dans le tableau suivant :
$$\begin{array}{|c|c|c|c|} \hline \text{Isomérie}&A&B&C\\ \hline \text{Couleur de la}&\text{violette}&\text{incolore}&\text{incolore}\\ \text{solution}& & & \\ \hline\text{Produits}&\text{rien}&D&E\text{ et }F\\ \hline \end{array}$$
Les ions permanganate $MnO_{4}^{-}$ (violets) se réduisent pour donner des ions manganèse $Mn^{2+}$ (incolores)
3) a) Peut on identifier un isomère ?
Si oui lequel ?
Justifier la réponse.
On réalise sur les produits $D$, $E$ et $F$ les tests dont les résultats sont consignés dans le tableau suivant :
$$\begin{array}{|c|c|c|} \hline \text{Réactif}&\text{Test à la }2.4-D.N.P.H&\text{Test au réactif de Schiff}\\ \hline D&\text{Positif}&\text{Négatif}\\ \hline E&\text{Négatif}&\text{Négatif}\\ \hline F&\text{Positif}&\text{Positif}\\ \hline \end{array}$$
3) b) Que met en évidence un test positif à la $2.4-D.N.P.H$ ?
Est-il suffisant pour identifier $D$ et $F$ ?
3) c) Que met en évidence un test positif au réactif de Schiff ?
3) d) Déduire la fonction chimique de chacun des composés $D$, $E$ et $F.$
Identifier les alcools $B$ et $C$ sachant quel alcool $C$ possède une chaine ramifiée
Exercice 12
On réalise en présence d'acide sulfurique, l'hydratation du propène.
1. Montrer que l'on peut prévoir théoriquement la formation de deux alcools $(A_{1})$ et $(A_{2}).$
Préciser le nom et la classe de chacun d'eux.
2. L'oxydation ménagée de l'alcool $(A_{1})$, avec le bichromate de potassium $K_{2}Cr_{2}O_{7}$ en milieu acide ; donne un produit $(B_{1})$ et l'alcool $(A_{2})$ donne un produit $(B_{2}).$
$(B_{1})$ et $(B_{2})$ donnent un précipité jaune avec le $2.4-D.N.P.H.$
Seul $(B_{2})$ rosit le réactif de Schiff.
2.1 Quelle est la fonction chimique du produit $(B_{2})$ ?
Donner son nom et sa formule semi-développée.
2.2 Identifier l'alcool $(A_{2}).$
Justifier.
2.3 Identifier l'alcool $(A_{1})$ ?
En déduire la fonction chimique, le nom et la formule semi-développée du produit $(B_{1}).$
3. Un acide carboxylique $(C)$ peut être obtenu par oxydation ménagée de l'un de deux alcools $(A_{1})$ et $(A_{2})$ précédents.
3.1 De quel alcool s'agit-il ?
Justifier.
3.2 Donner le nom et la formule semi-développée de l'acide $(C)$ obtenu
Exercice 13
Un composé organique ne contenant que du carbone, de l'hydrogène et de l'oxygène a une masse molaire de $74\,g/mol.$
On prélève $1.48\,g$ de ce composé et on le fait réagir dans un eudiomètre avec un excès de dioxygène.
L'analyse des gaz obtenus donne les résultats suivants :
$\bullet\ $ masse de dioxyde de carbone : $3.52\,g.$
$\bullet\ $ masse d'eau : $1.8\,g.$
1. Quelle est la formule bute de ce composé
2. Ce composé peut être obtenu par addition d'eau sur un hydrocarbure $A.$
2.1 A quelle famille d'hydrocarbures appartient $A$ ?
Donner sa formule brute.
2.2 Donner les isomères de $A$ et identifier ceux qui présentent une isomère $Z–E.$
2.3 Après avoir rappelé la règle de Markovnikov, identifier le(s) composé(s) $A$ qui respecte(nt) cette règle ; appliquer cette règle dans l'addition du chlorure d'hydrogène sur un isomère (de votre choix ) de $A.$
3. Le composé $A$ est obtenu par hydrogénation catalytique d'un autre hydrocarbure $B.$
3.1 A quelle famille précise appartient le composé $B$ ?
3.2 Écrire l'équation-bilan de la réaction d'hydrogénation de $B$ donnant $A$ en précisant la nature la nature du catalyseur.
3.3 Quel hydrocarbure obtient-on si l'hydrogénation de $B$ a lieu en présence de nickel comme catalyseur.
Écrire l'équation-bilan de cette réaction.
$O\ :\ 16\,g/mol\ ;\ C\ :\ 12\,g/mol\ ;\ H\ :\ 1\,g/mol$
Correction des exercices

Commentaires
Ariache (non vérifié)
mar, 06/30/2020 - 01:47
Permalien
Correction
Meton (non vérifié)
jeu, 02/11/2021 - 17:36
Permalien
Tout
Mariusco (non vérifié)
lun, 03/06/2023 - 22:28
Permalien
J'aime la science
Mariusco (non vérifié)
lun, 03/06/2023 - 22:28
Permalien
J'aime la science
Ass diop (non vérifié)
dim, 06/27/2021 - 12:30
Permalien
Je veut devenu fort en pc
Vida (non vérifié)
lun, 04/11/2022 - 22:12
Permalien
Réussir
boubacar diallo (non vérifié)
sam, 06/11/2022 - 19:45
Permalien
cours
Gfhhhff (non vérifié)
lun, 02/20/2023 - 21:24
Permalien
Rdfv
Tahya (non vérifié)
mer, 02/19/2025 - 18:00
Permalien
6c
Khadim (non vérifié)
jeu, 04/17/2025 - 22:28
Permalien
Élève
Meton (non vérifié)
jeu, 02/11/2021 - 17:32
Permalien
Tout
Khadim (non vérifié)
jeu, 04/17/2025 - 22:28
Permalien
Élève
Franck ehoussou (non vérifié)
dim, 02/14/2021 - 12:31
Permalien
Solution
Nzamba (non vérifié)
mar, 03/30/2021 - 06:17
Permalien
Bac22
AROUNA Bouba (non vérifié)
dim, 03/03/2024 - 15:41
Permalien
Solution
Fatimetou (non vérifié)
ven, 06/07/2024 - 16:08
Permalien
Apprendre
Kamagate (non vérifié)
ven, 02/26/2021 - 00:56
Permalien
Bac
Mariame (non vérifié)
lun, 05/10/2021 - 23:08
Permalien
Réussite
Mariem (non vérifié)
ven, 04/02/2021 - 19:47
Permalien
Solution serie
Thio (non vérifié)
mar, 05/21/2024 - 09:42
Permalien
Réussir
Palaye (non vérifié)
dim, 05/23/2021 - 09:33
Permalien
Correction série
Basse (non vérifié)
ven, 06/18/2021 - 13:07
Permalien
Réussite
Jules (non vérifié)
dim, 03/20/2022 - 13:13
Permalien
Réussir
Diagne (non vérifié)
lun, 04/11/2022 - 19:46
Permalien
Merci beaucoup
Anonyme (non vérifié)
mar, 04/12/2022 - 09:56
Permalien
Svp la correction
Omar (non vérifié)
mer, 05/18/2022 - 15:26
Permalien
Correction
Omar (non vérifié)
mer, 05/18/2022 - 15:26
Permalien
Correction
Greg (non vérifié)
sam, 12/10/2022 - 19:24
Permalien
Correction
chef (non vérifié)
mer, 03/29/2023 - 14:24
Permalien
correction
Ibrahima Ndao (non vérifié)
sam, 04/15/2023 - 13:25
Permalien
Excellente series d'exercices
Anonyme (non vérifié)
mar, 05/09/2023 - 08:11
Permalien
S'est nul proposer des
kanny (non vérifié)
mar, 05/09/2023 - 22:33
Permalien
pc love you
Anonyme (non vérifié)
ven, 05/26/2023 - 13:45
Permalien
la correction svp
André (non vérifié)
lun, 12/18/2023 - 01:59
Permalien
Appréciations
Anonyme (non vérifié)
sam, 02/03/2024 - 01:25
Permalien
E
Anonyme (non vérifié)
sam, 02/24/2024 - 20:05
Permalien
Pourquoi y'a pas de
Soro (non vérifié)
mar, 03/26/2024 - 14:57
Permalien
Correction
Génie (non vérifié)
sam, 03/30/2024 - 09:11
Permalien
C'est bien fait
Anonyme (non vérifié)
jeu, 05/02/2024 - 19:54
Permalien
correction des exercices
Mohamed sarr (non vérifié)
sam, 06/15/2024 - 09:45
Permalien
Téléphone
Christian (non vérifié)
dim, 01/04/2026 - 05:14
Permalien
Science
Ajouter un commentaire