Solution des exercices : Généralités sur la chimie organique
Exercice 1
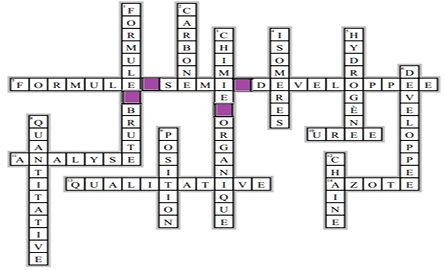
Exercice 2
1. 1. Indiquons si les composés chimiques suivants sont des composés organiques ou minéraux
$\begin{array}{|c|c|} \hline \text{Composés organiques }&\text{Composés mineéraux }\\
\hline C_{4}H_{10}\ ;\ C_{2}H_{3}C1\ ;\ C_{7}H_{5}O_{2}Na&NO_{2}\ ;\ NH_{3}\ ;\ CO\ ;\ C\\
\hline \end{array}$
2. Calcul de a masse molaire du glucose
$\begin{array}{rcl} M_{C_{6}H_{12}O_{6}}&=&6M_{C}+12M_{H}+6M_{0}\\&=&6\times 12+12\times 1.0+6\times 16\\&\Rightarrow& M_{C_{6}H_{12}O_{6}}\\&=&180\;,g\cdot mol^{-1} \end{array}$
Détermination de la composition centésimale massique du glucose
$\begin{array}{rcl} \%C&=&\dfrac{6M_{C}\times 100}{M_{C_{6}H_{12}O_{6}}}\\&=&\dfrac{6\times 12\times 100}{180}\\&\Rightarrow&\%C\\&=&40 \end{array}$
$\begin{array}{rcl} \%H&=&\dfrac{12M_{H}\times 100}{M_{C_{6}H_{12}O_{6}}}\\&=&\dfrac{12\times 1.0\times 100}{180}\\&\Rightarrow&\%H\\&=&6.7\end{array}$
$\begin{array}{rcl} \%C&=&\dfrac{6M_{0}\times 100}{M_{C_{6}H_{12}O_{6}}}\\&=&\dfrac{6\times 16\times 100}{180}\\&\Rightarrow&\%0\\&=&53.3
\end{array}$
Exercice 3
Établissement de la formule moléculaire brute de l'urée
$\begin{array}{rcl} \%H&=&100-\left(\%C+\%O+\%N\right)\\&=&100-(20.0+26.7+46)\\&\Rightarrow&\%H\\&=&7.3
\end{array}$
Soit $C_{x}H_{y}O_{z}N_{t}$ la formule brute correspondant au composé
$\begin{array}{rcl} \dfrac{112x}{\%C}&=&\dfrac{Y}{\%H}\\&=&\dfrac{16z}{\%O}\\&=&\dfrac{14t}{\%N}\\&=&\dfrac{M}{100}\end{array}$
$\begin{array}{rcl} \dfrac{12x}{\%C}&=&\dfrac{M}{100}\\&\Rightarrow&x\\&=&\dfrac{M\times \%C}{100\times 12}\\&=&\dfrac{60\times 20.0}{100\times 12}\\&\Rightarrow& x\\&=& \end{array}$ ;
$\begin{array}{rcl} \dfrac{Y}{\%H}&=&\dfrac{M}{100}\\&\Rightarrow&y\\&=&\dfrac{M\times \% H}{100}\\&=&\dfrac{60\times 7.3}{100}\\&\Rightarrow& y\\&=&4 \end{array}$
$\begin{array}{rcl} \dfrac{16z}{\%O}&=&\dfrac{M}{100}\\&\Rightarrow&z\\&=&\dfrac{M\times \%O}{100\times 16}\\&=&\dfrac{60\times 26.7}{100\times 16}\\&\Rightarrow&z\\&=&1 \end{array}$ ;
$\begin{array}{rcl} \dfrac{14t}{\%N}&=&\dfrac{M}{100}\\&\Rightarrow&t\\&=&\dfrac{M\times \%N}{100\times 14}\\&=&\dfrac{60\times 46}{100\times 14}\\&\Rightarrow&t\\&=&2 \end{array}$
D'où la formule brute $CH_{4}ON_{2}$
Exercice 4
$-\ $Détermination de la formule brute du composé organique
$\begin{array}{rcl} \%O&=&100-\left(\%C+\%H\right)\\&=&100-(40.0+6.67)\\&\Rightarrow&\%O\\&=&53.43 \end{array}$
Soit $C_{x}H_{Y}O_{z}$ la formule correspondant au composé
$\begin{array}{rcl} \dfrac{112x}{\%C}&=&\dfrac{y}{\%H}\\&=&\dfrac{16z}{\%O}\\&=&\dfrac{M}{100}\\&=&\dfrac{\rho V_{m}}{100}\\&\text{Avec }&M=\rho V_{m} \end{array}$
$\begin{array}{rcl} \dfrac{12x}{\%C}&=&\dfrac{\rho V_{m}}{100}\\&\Rightarrow&x&\\&=&\dfrac{p\rho V_{m}\times\%C}{100\times 12}\\&=&\dfrac{1.34\times 22.4\times 40.0}{100\times 12}\\&\Rightarrow& x\\&=&1 \end{array}$
$\begin{array}{rcl}\dfrac{y}{\%H}&=&\dfrac{\rho V_{m}}{100}\\&\Rightarrow&y\\&=&\dfrac{\rho V_{m}\times \%H}{100}\\&=&\dfrac{1.34\times 22.4\times 6.67}{100}\\&\Rightarrow&y\\&=&2 \end{array}$
$\begin{array}{rcl} \dfrac{16z}{\%O}&=&\dfrac{\rho V_{m}}{100}\\&\Rightarrow&z\\&=&\dfrac{\rho V_{m}\times \%O}{100\times 16}\\&=&\dfrac{1.34\times 22.4\times 53.43}{100\times 16}\\&\Rightarrow&z\\&=&1 \end{array}$
D'où la formule brute : $CH_{2}O$
Exercice 5 :
Formule brute de la chlorophylle
1. Détermination de la composition centésimale massique de la chlorophylle.
$\%X=\dfrac{m_{x}\times 100}{m_{\text{composé}}}$
$\begin{array}{rcl} \%C&=&\dfrac{m_{c}\times 100}{m_{\text{composé}}}\\&\text{or}\dfrac{m_{c}}{m_{co_{2}}}\\&=&\dfrac{M_{c}}{M_{co_{2}}}\\&\Rightarrow&m_{c}\\&=&\dfrac{M_{c}\times m_{co_{2}}}{M_{co_{2}}}\\&\Rightarrow&\%C\\1+1\dfrac{M_{c}\times m_{co_{2}}\times 100}{m_{\text{composé}}\times M_{CO_{2}}}\\&=&\dfrac{12\times 27.13\times 100 }{10\times 44}\\&\Rightarrow&\%C\\&=&74 \end{array}$
$\begin{array}{\%H}&=&\dfrac{m_{H}\times 100}{m_{\text{composé}}}\\&\text{or }\dfrac{m_{H}}{m_{H_{2}o}}\\&=&\dfrac{2M_{H}}{M_{H_{2}O}}\\&\Rightarrow&m_{H}\\&=&\dfrac{2M_{H}\times m_{H_{2}o}}{M_{H_{2}o}}\\&\Rightarrow&\%H\\&=&\dfrac{2M_{H}\times m_{H_{2}O}\times 100}{m_{\text{composé}}\times M_{H_{2}o}}\\&=&\dfrac{2\times 1\times 7.29\times 100}{10\times 18}\\&\Rightarrow&\%H\\&=&8.1 \end{array}$
$\begin{array}{rcl} n_{N}&=&2n_{N_{2}}\\&=&2\dfrac{V}{V_{m}}\\&\Rightarrow&m_{N}\\&=&2\dfrac{V}{V_{m}}M_{N}\\&\text{or}\%N\\&=&\dfrac{m_{N}\times 100}{m_{\text{composé}}}\\&=&\dfrac{2VM_{N}\times 100}{m_{\text{composé}}\times V_{m}}\\&=&\dfrac{2\times 0.504\times 14\times 100}{10\times 22.4}\\&\Rightarrow&\%N\\&=&6.3
\end{array}$
$\begin{array}{rcl} \%O&=&100-\left(\%C+\%H+\%N+\%Mg\right)\\&=&100-(74+8.1+6.3+2.69)\\&\Rightarrow&\%O\\&=&9.11
\end{array}$
2. Calcul de la masse molaire de la chlorophylle.
$\begin{array}{rcl}\dfrac{M}{100}&=&\dfrac{M_{mg}}{\%M_{g}}\\&\Rightarrow&M\\&=&\dfrac{M_{Mg}\times 100}{\%M_{g}}\\&=&\dfrac{24\times 100}{2.69}\\&\Rightarrow&M\\&=&892\,g\cdot mol^{-1}\end{array}$
3- Déduction de la formule brute de la chlorophylle.
Soit $C_{x}H_{Y}O_{z}N_{t}M_{g}$ la formule brute correspondant au composé
$\begin{array}{rcl}\dfrac{12x}{\%C}&=&\dfrac{y}{\%H}\\&=&\dfrac{16z}{\%O}\\&=&\dfrac{14t}{\%N}\\&=&\dfrac{M}{100} \end{array}$
$\begin{array}{rcl} \dfrac{112x}{\%C}&=&\dfrac{M}{100}\\&\Rightarrow&x\\&=&\dfrac{M\times \%C}{100\times 12}\\&=&\dfrac{892\times 74}{100\times 12}\\&\Rightarrow&x\\&=&55\end{array}$ ;
$\begin{array}{rcl}\dfrac{y}{\%H}&=&\dfrac{M}{100}\\&\Rightarrow&y\\&=&\dfrac{M\times \%H}{100}\\&=&\dfrac{892\times 8.1}{100}\\&\Rightarrow&y\\&=&72\end{array}$
$\begin{array}{rcl}\dfrac{116z}{\%O}&=&\dfrac{M}{100}\\&\Rightarrow&z\\&=&\dfrac{M\times \%O}{1100\times 16}\\&=&\dfrac{892\times 9.11}{100\times 16}\\&\Rightarrow&\\&\Rightarrow&z\\&=&5\end{array}$
$\begin{array}{rcl}\dfrac{14t}{\%N}&=&\dfrac{M}{100}\\&\Rightarrow&t\\&=&\dfrac{M\times \%N}{100\times 114}\\&=&\dfrac{892\times 6.3}{100\times 14}\\&\Rightarrow&t\\&=&4\end{array}$
D'où la formule brute $C_{55}H_{72}O_{5}N_{14}$
4. Calcul de la masse de magnésium absorbée lorsqu'un individu consomme $200\,g$ de salade.
$\begin{array}{rcl}m&=&\dfrac{200\times 1}{500}\\&\Rightarrow& m\\&=&0.4\,g\end{array}$
Le nombre d'atomes de magnésium correspondant
$\begin{array}{rcl}N&=&n\times N_{A}\\&=&\dfrac{m}{M}\times N_{A}\\&=&\dfrac{0.4}{892}\times 6.02\cdot 10^{23}\\&\Rightarrow&N\\&=&2.710^{20}\end{array}$ atomes
Exercice 6
1- Détermination des masses de carbone, d'hydrogène d'azote et d'oxygène contenus dans $1.40\,g$ de $A$
La potasse absorbe le dioxyde de carbone ; on peut donc déterminer la masse de carbone contenu dans Le dioxyde de carbone
$\begin{array}{rcl}m_{c}&=&\dfrac{M_{c}\times m_{co_{2}}}{M_{co_{2}}}\\&=&\dfrac{12\times 2.38}{44}\\&\Rightarrow&m_{c}\\&=&0.65\,g\end{array}$
Les ponces sulfuriques absorbent l'eau
La masse d'eau obtenue est :
$\begin{array}{rcl}m_{H_{2}O}&=&3.38-2.38\\&=&1.10\,g\end{array}$
$\begin{array}{rcl}m_{H}&=&\dfrac{2M_{H}\times m_{m_{H_{2}o}}}{M_{H_{2}o}}\\&=&\dfrac{2\times 1.0\times 1.10}{118}\\&\Rightarrow&m_{H}\\&=&0.122\,g\end{array}$
La masse d'azote contenu dans $0.70\,g$ du composé organique $A$
$\begin{array}{rcl}n_{N}&=&2n_{N_{2}}\\&=&2\dfrac{V}{V_{m}}\\&\Rightarrow&m_{N}\\&=&2\dfrac{V}{V_{m}}M_{N}\\&=&2\times\dfrac{76\cdot 110^{-3}}{22.4}\times 14\\&\Rightarrow&m_{N}\\&=&0.095\,g\end{array}$
La masse d'azote contenu dans $1.40\,g$ du composé organique $A$
$\begin{array}{rcl}m_{N}&=&0.095\times \dfrac{1.40}{0.70}\\&\Rightarrow&m_{N}\\&=&0.19\,g\end{array}$
La masse d'oxygène contenu dans $1.40\,g$ du composé organique $A$
$\begin{array}{rcl}m_{o}&=&m-\left(m_{C}+m_{H}+m_{N}\right)\\&=&11.40-(0.65+0.122+0.190)\\&\Rightarrow&m_{o}\\&=&0.438\,g\end{array}$
2. La composition centésimale massique du composé $A$
$\begin{array}{rcl} \%C&=&\dfrac{m_{C}\times 100}{m_{A}}\\&=&\dfrac{0.65\times 100}{1.40}\\&\Rightarrow&\%C\\&=&46.4 \end{array}$
$\begin{array}{rcl} \%H&=&\dfrac{m_{H}\times 100}{m_{A}}\\&=&\dfrac{0.122\times 100}{1.40}\\&\Rightarrow&\%H\\&=&8.7 \end{array}$
$\begin{array}{rcl} \%O&=&\dfrac{m_{o}\times 100}{m_{A}}\\&=&\dfrac{0.438\times 100}{1.40}\\&\Rightarrow&\%N\\&=&31.3 \end{array}$
$\begin{array}{rcl} \%N&=&\dfrac{m_{N}\times 100}{m_{A}}\&=&\dfrac{0.19\times 100}{1.40}\\&\Rightarrow&\%N\\&=&13.6 \end{array}$
3- Déduction de la formule brute de $A$
Soit $C_{x}H_{y}O_{z}N$ la formule correspondant au organique $A$
$\begin{array}{rcl} \dfrac{M}{100}&=&\dfrac{114}{\%N}\\&\Rightarrow&M\dfrac{14\times 100}{13.6}\\&\Rightarrow&M\\&=&102.9\,g\cdot mol^{-1} \end{array}$
$\begin{array}{rcl} x&=&\dfrac{M\times\%C}{100\times 12}\\&=&\dfrac{102.9\times 46.4}{100\times 12}\\&\Rightarrow&x\\&=&4 \end{array}$ ;
$\begin{array}{rcl} y&=&\dfrac{M\times \%hH}{100}\\&=&\dfrac{102.9\times 8.7 }{100}\\&\Rightarrow&y\\&=&9
\end{array}$
$\begin{array}{rcl} z&=&\dfrac{M\times \%O}{100\times 16}\\&=&\dfrac{102.9\times 31.3}{100\times 16}\\&\Rightarrow&z\\&=&2 \end{array}$ ;
D'où la formule brute $C_{4}H_{9}O_{2}N$
Exercice 7
1. On prouve la présence de l'élément carbone dans un composé organique lors de la combustion du composé où le carbone est transformé en dioxyde de carbone absorbable par la potasse
L'hydrogène est transformé en eau absorbable par les ponces sulfuriques.
2. Détermination de :
2.1. La quantité de gaz correspondant à $1.20\,g$ de gaz
$\begin{array}{rcl} n&=&\dfrac{V}{V_{m}}\\&=&\dfrac{0.62}{31.0}\\&\Rightarrow&n\\&=&0.02\mol \end{array}$
2.2 La massa molaire de $A$
$\begin{array}{rcl} M_{A}&=&\dfrac{m}{n}\\&=&\dfrac{1.20}{0.02}\\&\Rightarrow&M_{A}\\&=&60\,g\cdot mol^{-1}
\end{array}$
3.1 Détermination des masses de carbone d'hydrogène et d'oxygène dans une mole.
$\begin{array}{rcl} \%X&=&\dfrac{m_{x}\times 100}{m_{A}}\\&\Rightarrow&m_{x}\\&=&\dfrac{\%X\times m_{A}}{100}\\&\text{or }&m\\&=&n\times M\\&\text{et }&n\\&=&1\mol\\&\Rightarrow&m_{x}\\&=&\dfrac{\%X\times M_{A}}{100}\end{array}$
$\begin{array}{rcl} m_{c}&=&\dfrac{\%C\times M_{A}}{100}\\\&=&\dfrac{60.0\times 60}{100}\\&\Rightarrow&\,m_{c}\\&=&36\,g \end{array}$ ;
$\begin{array}{rcl} m_{H}&=&\dfrac{\%H\times M_{A}}{100}\\&=&\dfrac{13.3\times 60}{100}\\&\Rightarrow&m_{H}\\&=&7.98\,g \end{array}$
$\begin{array}{rcl} m_{o}&=&\dfrac{\%C\times M_{A}}{100}\\&=&\dfrac{26.7\times 60}{100}\\&\Rightarrow&m_{o}\\&=&16.02\,g \end{array}$
3.2. Déduction de la formule brute de $A$
Soit $C_{x}H_{y}O_{z}$ la formule brute correspondant au composé organique $A$
$\begin{array}{rcl} m_{c}&=&12x\\&=&36\,g\\&\Rightarrow&x\\&=&\dfrac{36}{12}\\&\Rightarrow&x\\&=&3\end{array}$
$\begin{array}{rcl} m_{H}&=&1.0\times y\\&=&7.98\,g\\&\Rightarrow&y\\&=&\dfrac{7.98}{1.0}\\&\Rightarrow&y\\&=&8
\end{array}$
$\begin{array}{rcl} m_{o}&=&16z\\&=&16.02\,g\\&\Rightarrow&z\\&=&\dfrac{16.02}{16}\\&\Rightarrow&z\\&=&1
\end{array}$
D'où la formule bruite $C_{3}H_{8}O$
4. Proposition de deux formules semi-développées différentes de $A$
$CH_{3}-CH_{2}-CH_{2}OH$ ou $CH_{3}-CHOH-CH_{3}$ $\left(\text{ou }CH_{3}-O-CH_{2}-CH_{3}\right)$
Exercice 8
1. Calcul de la masse de carbone existant dans $11.32\,g$ de $CO_{2}$
$\begin{array}{rcl} \%C&=&\dfrac{m_{c}\times 100}{m}\\&=&\dfrac{0.36\times 100}{0.44}\\&\Rightarrow&\%C\\&=&82\end{array}$
2. Déduction du pourcentage d'hydrogène dans l'échantillon.
$\%H=100-\%C=10082\Rightarrow\%H=18$
3. Écriture d'une relation entre $x$ et $y$
$\begin{array}{rcl} M_{C_{x}H_{y}}&=&44\,g\mol^{-1}\\&\Rightarrow&12x+y\\&=&44 \end{array}$
4. En appliquant la règle du pourcentage à une mole, déterminons $x$ et $y$
Pour une mole la masse correspond à la masse molaire
$\begin{array}{rcl} \dfrac{12x}{\%C}&=&\dfrac{y}{\%H}\\&=&\dfrac{M}{100} \end{array}$
$\begin{array}{rcl} \dfrac{12x}{\%C}&=&\dfrac{M}{100}\\&\Rightarrow&x\\&=&\dfrac{\%C\times M}{112\times 100}\\&=&\dfrac{82\times 44}{12\times 100}\\&\Rightarrow&x\\&=&3 \end{array}$
$\begin{array}{rcl}12x+y&=&44\\&\Rightarrow&y\\&=&44-12x\\&=&44-1112\times 3\\&\Rightarrow&y\\&=&8\\&\Rightarrow&C_{3}H_{8}
\end{array}$
Exercice 9
$\begin{array}{rcl} C_{Asp}V_{Asp}&=&C_{\text{soude}}V_{\text{soude}}\\&\Rightarrow&C_{Asp}V_{Asp}\\&=&\dfrac{C_{\text{soude}}V_{\text{soude}}}{V_{Asp}}\\&\text{or}&n_{Asp}\\&=&C_{Asp}V\\&=&\dfrac{C_{\text{soude}}V_{\text{soude}}}{V_{Asp}}V\\&\Rightarrow&M\\&=&\dfrac{m_{Asp}}{n_{Asp}}\\&=&\dfrac{m_{Asp}\times V_{\text{soude}}}{C_{\text{soude}}V_{\text{soude}}\times V} \end{array}$
$\begin{array}{rcl} M&=&\dfrac{0.1\times 10}{0.01\times 1111.1\times 50\cdot 10^{-3}}\\&\Rightarrow&M\\&=&180\,g\cdot mol^{-1} \end{array}$
2. Détermination de la formule brute de l'aspirine $C_{x}H_{y}O_{x}$
$\begin{array}{rcl} \dfrac{12x}{\%C}&=&\dfrac{y}{\%H}\\&=&\dfrac{16z}{\%O}\\&=&\dfrac{M}{100}\end{array}$
$\begin{array}{rcl} \dfrac{12x}{\%C}&=&\dfrac{M}{100}\\&\Rightarrow&x\\&=&\dfrac{M\times\%C}{100\times 12}\\&=&\dfrac{180\times 60}{100\times 12}\\&\Rightarrow&x\\&=&9 \end{array}$
$\begin{array}{rcl} \dfrac{y}{\%H}&=&\dfrac{M}{100}\\&\Rightarrow&y\\&=&\dfrac{M\times H}{100}\\&=&\dfrac{180\times 4.5}{100}\\&\Rightarrow&y\\&=&8 \end{array}$
^$\begin{array}{rcl} \dfrac{16z}{\%O}&=&\dfrac{M}{100}\\&\Rightarrow&z&\\&=&\dfrac{M\times\%O}{100\times
16}\\&=&\dfrac{180\times 35.5}{100\times 116}\\&\Rightarrow&z\\&=&4 \end{array}$
D'où la formule bruite $C_{9}H_{8}O_{4}$
Exercice 10
1. Calcul de la masse de carbone et la masse d'hydrogène contenu dans l'échantillon.
$\begin{array}{rcl} m_{C}&=&\dfrac{M_{c}\times m_{co_{2}}}{M_{co_{2}}}\\&=&\dfrac{12\times 2.2}{44}\\&\Rightarrow&m_{c}\\&=&0.6\,g \end{array}$
$\begin{array}{rcl} m_{H}&=&\dfrac{2M_{H}\times m_{H_{2}o}}{M_{H_{2}o}}\\&=&\dfrac{1.0\times 0.9}{18}\\&\Rightarrow&m\\&=&0.11\,g \end{array}$
Déduction de $m$
$\begin{array}{rcl} m&=&m_{c}+m_{H}\\&=&0.6+0.1\\&\Rightarrow&m\\&=&0.7\,g \end{array}$
2. Calcul du pourcentage de carbone et d'hydrogène dans le composé.
$\begin{array}{rcl} \%C&=&\dfrac{m_{c}\times 100}{m}\\&=&\dfrac{0.06\times 100}{0.7}\\&\Rightarrow&\%C\\&=&85.7
\end{array}$
$\begin{array}{rcl} \%H&=&\dfrac{m_{H}\times 100}{m}\\&=&\dfrac{0.1\times 100}{0.7}\\&\Rightarrow&\%H\\&=&114.3
\end{array}$
3. Détermination de la formule brute du composé.,
$\begin{array}{rcl} \dfrac{112x}{\%C}&=&\dfrac{y}{\%H}\\1+1\dfrac{M}{100} \end{array}$
$\begin{array}{rcl} \dfrac{12x}{\%C}&=&\dfrac{M}{100}\\&\Rightarrow&x\\&=&\dfrac{M\times \%C}{100\times 12}\\&=&\dfrac{70\times 85.7}{100\times 12}\\&\Rightarrow&x\\&=&5 \end{array}$
$\begin{array}{rcl} \dfrac{y}{\%H}&=&\dfrac{M}{100}\\&\Rightarrow&y\\&=&\dfrac{M\times\%H}{100}\\&=&\dfrac{70\times 14.3}{100}\\&\Rightarrow&y\\&=&10\end{array}$
La formule brute est donc : $C_{5}H_{10}$
4. Équation de la réaction de combustion.
$C_{5}H_{10}+\dfrac{15}{2}O_{2}\rightarrow 5CO_{2}+5H_{2}O$
5. Calcul du volume de dioxygène nécessaire à la combustion.
D'après le bilan molaire :
$\begin{array}{rcl} \dfrac{m}{M}&=&\dfrac{\dfrac{V}{V_{M}}}{\dfrac{15}{2}}\\&\Rightarrow&\dfrac{m}{M}\\&=&\dfrac{2V}{15V_{M}}\\&\Rightarrow&V\\&=&\dfrac{115m\times V_{M}}{M}\\&=&\dfrac{115\times 0.7\times 24}{70}\\&\Rightarrow&V\\&=&3.6\,L \end{array}$
Exercice 11
1. Équation équilibrée de la réaction de combustion.
$C_{x}H_{y}O_{z}+\left(x+\dfrac{y}{4}-\dfrac{z}{2}\right)O_{2}\rightarrow xCO_{2}+\dfrac{y}{2}H_{2}O$
2. En utilisant la correspondance en nombre de moles montrons que $x=2y$
Déterminons le nombre de moles de dioxyde de carbone et d'eau
$\begin{array}{rcl} n_{co_{2}}&=&\dfrac{m_{co_{2}}}{M_{co_{2}}}\\&=&\dfrac{8.8}{44}\\&\Rightarrow&n_{co_{2}}\\&=&0.2\,mol \end{array}$ ;
$\begin{array}{rcl} n_{H_{2}O}&=&\dfrac{m_{H_{2}O}}{M_{H_{2}O}}\\&=&\dfrac{4.5}{18}\\&\Rightarrow&n_{H_{2}O}\\&=&0.25\mol \end{array}$
D'après le bilan molaire :
$\begin{array}{rcl} \dfrac{n_{co_{2}}}{x}&=&\dfrac{n_{H_{2}O}}{\dfrac{y}{2}}\\&\Rightarrow&2x\times n_{H_{2}O}\\&=&y\times n_{co_{2}}\\&\Rightarrow&2x\times 0.25\\&=&y\times 0.2\\&\Rightarrow&2x\times 2.5\\&=&y\times 2\\&\Rightarrow& 5x\\&=&2y \end{array}$
3.1. Calcul du volume $v_{O_{2}}$ de dioxygène ayant réagi.
$\begin{array}{rcl} V_{o_{2}}&=&10-2.8\\&\Rightarrow&V_{o_{2}}\\&=&7.2\,L \end{array}$
3.2 Montrons que $x=4z$ et $y=10z$
On donne $V_{M}=24\,L\cdot mol^{-1}$
Le nombre de moles de dioxygène utilisé :
$\begin{array}{rcl} n_{o_{2}}&=&\dfrac{V_{o_{2}}}{V_{M}}\\&=&\dfrac{7.2}{24}\\&\Rightarrow&n_{o_{2}}\\&=&0.3\,mol \end{array}$
D'après le bilan molaire :
$\begin{array}{rcl} \dfrac{n_{co_{2}}}{x}&=&\dfrac{n_{o_{2}}}{x+\dfrac{y}{4}-\dfrac{z}{2}}\\&\text{or }5x\\&=&2y\\&\Rightarrow&y\\&=&\dfrac{5x}{2}\\&\Rightarrow&\dfrac{0.2}{x}\\&=&\dfrac{0.3}{x+\dfrac{1}{4}\dfrac{5x}{2}-\dfrac{z}{2}}\\&\Rightarrow&\left(x+\dfrac{5x}{8}-\dfrac{z}{2}\right)\\&=&3x\\&\Rightarrow&2x+\dfrac{5x}{4}-z\\&=&3x\\&\Rightarrow&8x+5x-4z\\&=&12x\\&\Rightarrow&x\\&=&4z \end{array}$
$\begin{array}{rcl} 5x&=&2y\\&\Rightarrow&x\\&=&\dfrac{2}{5}y\\&\text{or }&x\\&=&4z\\&\Rightarrow&\dfrac{2}{5}y\\&=&4z\\&\Rightarrow&2y\\&=&20z\\&=&74\\&\Rightarrow&z\\&=&1\\&\Rightarrow&x\\&=&4\text{et }y\\&=&10\\&\Rightarrow&C_{2}H_{10}O \end{array}$
4.1 Détermination de la formule brute de ce composé
$\begin{array}{rcl} M_{C_{x}H_{y}O_{z}}&=&12x+y+16z\\&=&74\\&\text{or }&x\\&=&4z\\&\text{et }y\\&=&10z\\&\Rightarrow&12\times 4z+10z+16z\\&=&74\\&\Rightarrow&74z\\&=&74\\&\Rightarrow&z\\&=&1\\&\Rightarrow&x\\&=&4\\&\text{et }&y\\&=&10\\&\Rightarrow&C_{4}H_{10}O \end{array}$
4.2 Calcul de la masse $m$
D'après le bilan molaire :
$\begin{array}{rcl} n&=&n_{O_{2}}\\&\Rightarrow&\dfrac{m}{M}\\&=&n_{O_{2}}\\&\Rightarrow&m\\&=&0.3\times 74\\&\Rightarrow&m\\&=&22.2\,g \end{array}$
4.3. Détermination de la composition massique du composé en carbone, hydrogène et oxygène.
$\begin{array}{rcl} m_{C}&=&\dfrac{M_{C}\times m_{CO_{2}}}{M_{CO_{2}}}\\&=&\dfrac{12\times 8.8}{44}\\&\Rightarrow&m_{c}\\&=&2.4\,g \end{array}$
$\begin{array}{rcl} m_{H}&=&\dfrac{2M_{H}\times m_{H_{2}O}}{M_{H_{2}O}}\\&=&\dfrac{2\times 1.0\times 4.5}{18}\\&\Rightarrow&m_{H}\\&=&0.5\,g \end{array}$
$\begin{array}{rcl} m_{O}&=&m-\left(m_{C}+m_{H}\right)\\&=&22.2-(2.4+0.5)\\&\Rightarrow&m_{o}\\&=&19.3\,g
\end{array}$
Exercice 12
1. Détermination des masses de carbones,d'hydrogène et d'azote contenues dans les $0.45\,g$ du composé.
$\begin{array}{rcl} m_{C}&=&\dfrac{M_{C}\times m_{CO_{2}}}{M_{CO_{2}}}\\&=&\dfrac{112\times 0.88}{44}\\&\Rightarrow&m_{C}\\&=&0.24\,g \end{array}$
$\begin{array}{rcl} m_{H}&=&\dfrac{2M_{H}\times m_{H_{2}O}}{M_{H_{2}O}}\\&=&\dfrac{2\times 1.0\times 0.63}{18}\\&\Rightarrow&m_{H}\\&=&0.07\,g \end{array}$
$\begin{array}{rcl} m_{N}&=&\dfrac{M_{N}\times m_{NH_{3}}}{M_{NH_{3}}}\\&=&\dfrac{14\times 0.17}{17}\\&\Rightarrow&m_{C}\\&=&0.114\,g \end{array}$
Montrons si le composé contient de l'oxygène
$\begin{array}{rcl} m_{C}+m_{H}+m_{N}\\1+1M-\\&=&0.24+0.07+0.14\\&=&0.45\,g\\&=&m \end{array}$
Le composé ne contient pas de l'oxygène
2. La composition centésimale du composé
$\begin{array}{rcl} \%C&=&\dfrac{m_{C}\times 100}{m}\\&=&\dfrac{0.24\times 100}{0.45}\\&\Rightarrow&\%C\\&=&53.3
\end{array}$
$\begin{array}{rcl} \%H&=&\dfrac{m_{H}\times 100}{m}\\&=&\dfrac{0.07\times 100}{0.45}\\&\Rightarrow&\%H\\&=&15.6
\end{array}$
$\begin{array}{rcl} \%C&=&\dfrac{m_{C}\times 100}{m}\\&=&\dfrac{0.14\times 100}{0.45}\\&\Rightarrow&\%N\\&=&31.1
\end{array}$
3- Calcul d'une valeur approchée de la masse molaire
$\begin{array}{rcl} M&=&\rho V_{M}\\&=&2\times 22.4\\&\Rightarrow&M\\&=&45\,g\cdot mol^{-11} \end{array}$
Détermination de la formule brute $C_{x}H_{y}N_{t}$
$\begin{array}{rcl} \dfrac{12x}{\%C}&=&\dfrac{Y}{\%H}\\&=&\dfrac{14t}{\%N}\\&=&\dfrac{M}{100} \end{array}$
$\begin{array}{rcl} \dfrac{12x}{\%C}&=&\dfrac{M}{100}\\&\Rightarrow&x\\&=&\dfrac{M\times \%C}{100\times 12}\\&=&\dfrac{45\times 53.3}{100\times 12}\&\Rightarrow&x\\&=&2 \end{array}$ ;
$\begin{array}{rcl} \dfrac{Y}{\%H}&=&\dfrac{M}{100}\\&\Rightarrow&y\\&=&\dfrac{M\times \%H}{100}\\&=&\dfrac{45\times 15.6}{100}\\&\Rightarrow&y\\&=&7 \end{array}$
$\begin{array}{rcl} \dfrac{14t}{\%N}\\&=&\dfrac{M}{100}\\&\Rightarrow&t\\&=&\dfrac{M\times \%N}{100\times 14}\\&=&\dfrac{45\times 31.3}{100\times 14}\\&\Rightarrow&t\\&=&1 \end{array}$
La formule bruite est donc : $C_{2}H_{7}N$
Exercice 13
1. Trouvons la formule bruite du composé organique
$\begin{array}{rcl} \%O&=&100-\left(\%C+\%H+\%N\right)\\&=&100-(15.90+2.20+18.50)\\&\Rightarrow&\%O\\&=&63.4
\end{array}$
$\begin{array}{rcl} \dfrac{12x}{\%C}&=&\dfrac{Y}{\%H}\\&=&\dfrac{14t}{\%N}\\&=&\dfrac{M}{100}\\&=&\dfrac{29d}{100} \end{array}$
$\begin{array}{rcl} \dfrac{12x}{\%C}&=&\dfrac{29d}{100}\\&\Rightarrow&x\\&=&\dfrac{29d\times \%C}{100\times 12}\\&=&\dfrac{29\times 7.82\times 15.90}{100\times 12}\\&\Rightarrow&x\&=&3 \end{array}$
$\begin{array}{rcl} \dfrac{y}{\%H}&=&\dfrac{29d}{100}\\&\Rightarrow&y\\&=&\dfrac{29d\times \%H}{100}\\&=&\dfrac{29\times 7.82\times 2.20}{100}\\&\Rightarrow&y&=&5 \end{array}$
$\begin{array}{rcl}
\dfrac{16z}{\%N}&=&\dfrac{29d}{100}\\&\Rightarrow&z\\&=&\dfrac{29d\times \%N}{100\times 16}\\&=&\dfrac{29\times 7.82\times 63.4}{100\times 16}\\&\Rightarrow&z\\&=&9
\end{array}$
$\begin{array}{rcl} \dfrac{141t}{\%N}&=&\dfrac{29d}{100}\\&\Rightarrow&t\\&=&\dfrac{29d\times \%N}{100\times 14}\\&=&\dfrac{29\times 7.82\times 18.50}{100\times 14}\\&\Rightarrow&t\\&=&3 \end{array}$
La formule brute est donc : $C_{3}H_{5}O_{9}N_{3}$
2.2-Calcul du volume gazeux total libéré par l'explosion de $10\,g$ de nitroglycérine
$\begin{array}{rcl} V&=&V_{CO_{2}}+V_{O_{2}}+V_{N_{2}}\\&=&\left(n_{CO_{2}}+n_{O_{2}}+n_{N_{2}}\right)V_{M}\\&\text{or }n\\&=&\dfrac{m}{M}\\&=&\dfrac{n_{CO_{2}}}{\dfrac{5}{2}}\\&=&\dfrac{n_{O_{2}}}{\dfrac{1}{2}}\\&=&\dfrac{n_{N_{2}}}{\dfrac{3}{2}}\\&\Rightarrow&V\\&=&\left(\dfrac{5}{2}\dfrac{m}{M}+\dfrac{1}{2}\dfrac{m}{M}+\dfrac{3}{2}\dfrac{m}{M}\right)V_{M}\\&\Rightarrow&V\\&=&\dfrac{9}{2}\dfrac{m}{M}V_{M}\\&=&\dfrac{9}m{2\times 29d}V_{M}\\&=&\dfrac{9\times 10}{2\times 29\times 7.82}\times 24\\&\Rightarrow&V\\&=&4.76\,L \end{array}$

Ajouter un commentaire