Piles électrochimiques : exemple de la pile Daniell - 1er L
Classe:
Première
I. La pile Daniell
1. Constitution et réalisation
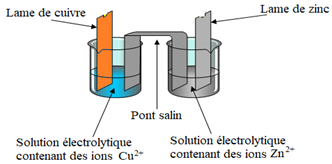
La pile Daniell est formée de demi-piles :
$\blacktriangleright\ $La demi-pile $Cu^{2+}/Cu$ est constituée par un récipient renfermant une solution de sulfate de cuivre $(II)$ à $0.10mol\cdot L^{-1}$ dans laquelle plonge une électrode de cuivre.
$\blacktriangleright\ $La demi-pile $Zn^{2+}/Zn$ est constituée par un récipient renfermant une solution de sulfate de zinc $(II)$ à $0.10mol\cdot L^{-1}$ dans laquelle plonge une électrode de zinc.
Les deux solutions sont réunies par un pont salin.
Ce pont peut être réalisé par une languette de papier filtre imbibée d'une solution concentrée de nitrate de sodium $NaNO_{3}.$
Il peut aussi être réalisé par un tube en $U$ contenant une solution de chlorure (ou nitrate) de potassium.
2. Polarité et caractéristiques.
1.2.1. Polarité
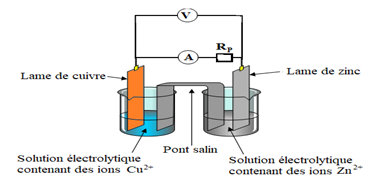
$\blacktriangleright\ $L'ampèremètre (ou le voltmètre) branché aux deux électrodes indique la circulation du courant électrique (ou une tension), le branchement et le sens de déviation de l'aiguille montre que l'électrode de cuivre constitue la borne positive de la pile et l'électrode de zinc la borne négative.
1.2.2. Fonctionnement
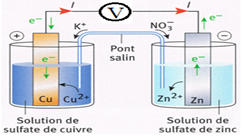
Lorsque la pile débite, les porteurs de charges sont de deux sortes :
$\blacktriangleright\ $Dans le circuit extérieur à la pile, ce sont des électrons qui circulent dans les fils et les conducteurs de la borne négative $(-)$ vers la borne positive $(+)$
$\blacktriangleright\ $Dans le pont salin et dans les solutions, ce sont des ions qui se déplacent.
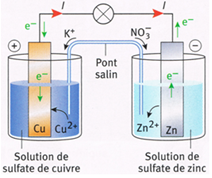
Le mouvement des ions dans le pont salin permet aux solutions de rester électriquement neutres.
Dans la demi-pile où se forment des cations (électrode négative), le pont salin apporte des anions et dans la demi-pile où les cations sont consommés (électrode positive) le pont salin apporte des cations.
Le pont salin assure donc la neutralité électrique et la fermeture du circuit
$\blacktriangleright\ $Si on relie les électrodes de la pile par un circuit comprenant en série, une résistance de protection $R_{P}$ et un ampèremètre (ou un voltmètre), celui-ci indique le passage d'un courant (ou d'une tension), la pile débite.
C'est un générateur.
$\bullet\ $L'électrode de zinc est le pôle négatif $(-)$ constitue l'anode.
Elle donne des électrons $e^{-}$ au circuit : $$Zn\ \longrightarrow\ Zn^{2+}\ +\ 2e^{-}$$
Il y a oxydation du métal zinc $Zn$ en ions zinc $(II)$ $Zn^{2+}$
$\bullet\ $L'électrode de cuivre est le pôle positif $(+)$ est la cathode.
Elle capte les électrons cédés :
$$Cu^{2+}\ +\ 2e^{-}\ \longrightarrow\ Cu$$
Il y a réduction des ions cuivre $(II)$ $Cu^{2+}$ en métal cuivre $Cu$
Le bilan chimique s'écrit : $$Zn\ +\ Cu^{2+}\ \longrightarrow\ Zn^{2+}\ +\ Cu$$
Remarque
La réaction d'oxydoréduction entre les ions cuivre $(II)$ $Cu^{2+}$ et le métal zinc $Zn$ s'accompagne d'une production de chaleur.
Elle est donc exothermique.
La pile transforme donc une partie de l'énergie chimique en énergie thermique ou calorifique.
1.3. Notation conventionnelle
La pile Daniel est représentée par l'écriture : $(-)Zn/Zn^{2+}// Cu^{2+}/Cu^{+}\;(+)$
La borne négative est placée à gauche, la borne positive à droite, la double barre symbolise le pont, les barres simples marquent la séparation électrique métallique-solution pour chaque demi-pile.
1.2.1. Force électromotrice
Un voltmètre de très grande résistance indique à l'absence du courant que la force électromotrice $f.é.m.$ de la pile Daniell $(d.d.p$ : la différence de potentielle$)$ entre l'électrode de cuivre et l'électrode de zinc est approximativement :
$$E=U_{Cu/Zn}=V_{Cu}-V_{Zn}=1.1V$$
$V_{Cu}$ est le potentiel de l'électrode de cuivre
2. Généralisation
Une pile est composée de :
$\blacktriangleright\ $Deux compartiments séparés appelés demi-piles contenant chacun une électrode (matériau conducteur, en général des métaux ou du carbone) et une solution électrolytique
$\blacktriangleright\ $Un pont salin ou une paroi poreuse reliant les $2$ demi-piles.
Chaque demi-pile est composée des espèces d'un couple oxydant/réducteur.
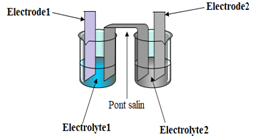
Le pont salin est constitué d'un tube en $U$ creux rempli d'une solution gélifiée conductrice concentrée (ou d'une simple feuille de papier imbibé d'une solution conductrice).
Les ions présents dans le pont salin $\left(\text{en général }K^{+}\text{ et }Cl^{-}\text{ ou }NO_{3}^{-}\right)$ n'interviennent pas dans la réaction d'oxydoréduction.
Leur rôle est de permettre le passage du courant dans la pile et d'assurer la neutralité électrique des solutions
Remarque
Souvent le couple est formé d'un ion métallique $M^n{+}$ et du métal $M.$
Si l'oxydant est un cation métallique $M^{n+}$ et le réducteur un métal $M$, la demi-pile associée à ce couple sera constituée d'une électrode de ce métal M plongeant dans une solution aqueuse du cation $M^{n+}$
Exemple :
le couple $Cu^{2+}/Cu$
Dans certains cas, l'électrode est constituée d'un matériau conducteur inerte.
Si l'oxydant et le réducteur sont tous deux des ions en solution, la demi-pile associée à ce couple sera constituée d'un mélange de deux solutions en égales concentrations molaires des deux espèces, dans lequel plonge une électrode inattaquable (désigné par M), en platine ou en graphite.
Exemple :
le couple $Pt\left(H_{2}\right)/H^{+}$
$\blacktriangleright\ $Réactions aux électrodes et équation-bilan



Les couples mis en jeu sont : $Ox_{1}/Red_{1}$ et $Ox_{2}/Red_{2}$
A la borne négative $(-)$ ou anode, il y a oxydation du réducteur $1$ : $$a\;Red_{1}\ \longrightarrow\ b\;Ox_{1}\ +\ n_{1}e^{-}$$
A la borne positive $(+)$ ou cathode, il y a réduction de l'oxydant $2$ : $$c\;Ox_{2}\ +\ n_{2}e^{-}\ \longrightarrow\ d\;Red_{2}$$
Réactions aux électrodes : $$\left(a\;Red_{1}\ \longrightarrow\ b\;Ox_{1}\ +\ n_{1}e^{-}\right)x\;n_{2}$$
$$\left(c\;Ox_{2}\ +\ n_{2}e^{-}\ \longrightarrow\ d\;Red_{2}\right)x\;n_{1}$$
Bilan :
$$a\cdot n_{2}Red_{1}\ +\ c\cdot n_{1}Ox_{2}\ \longrightarrow\ b\cdot n_{2}Ox_{1}\ +\ d\cdot n_{1}Red_{2}$$
$\blacktriangleright\ $Notation conventionnelle
La représentation formelle de la pile est obtenue en plaçant :
$-\ $La borne négative ou 'électrode négative (anode) représentée à gauche et la borne positive ou l'électrode positive (cathode) représentée à droite.
$-\ $Un trait vertical représentant une jonction entre deux phases (ici, métal-liquide).
$-\ $Un double trait vertical représentant une jonction entre deux demi-piles.
La pile est formellement représentée par : $(-)M/M^{n-}//M^{p+}/M(+)$
II. Autres piles
Les piles de type Daniell utilisent des solutions aqueuses salines, ces piles ne sont pas commodes pour un usage dans les appareils domestique parce qu'elles :
$-\ $ont une capacité électrique faible
$-\ $ne sont pas adoptées aux positions aléatoires de ces appareils
Donc il faut penser à d'autres types de piles : les piles sèches telles que les piles alcalines
$\blacktriangleright\ $L'électrolyte dans ce type de pile est l'hydroxyde de potassium $KOH.$
La solution de $KOH$ est gélifiée pour éviter son écoulement (la pile est dite sèche)
$\blacktriangleright\ $L'hydroxyde de potassium contient l'élément chimique $K$ est un alcalin appartient $1^{er}$ colonne du tableau périodique $(Li\;,\ Na\;,\ K).$
Les piles alcalines se diffèrent l'une de l'autre par la nature des couples redox mis en jeu et de leurs formes (cylindrique, plates, cylindrique plate (pile bouton))
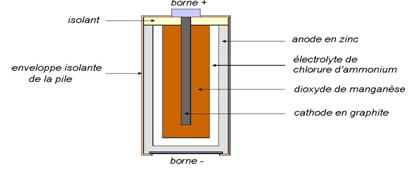
1. Pile à oxyde de manganèse
La pile alcaline à l'oxyde de manganèse présente des performances notablement améliorées par rapport à la pile Leclanché, pour un cout un peu supérieur.
1.1. Constitution
L'électrode positive est en oxyde de manganèse $MnO_{2}$ avec du graphite en poudre.
L'électrode négative est constituée de zinc $Zn$ en poudre.
L'électrolyte est une solution d'hydroxyde de potassium $K^{+}+HO^{-}$ avec divers additifs.
La pile à l'oxyde de manganèse est qualifiée d'alcaline car elle fonctionne en milieu basique.


1.2. Réactions électrochimiques
A l'électrode négative, qui joue le rôle d'anode, le zinc $Zn$ est oxydé en oxyde de zinc $ZnO$ :
$$Zn(s)\ +\ 2HO^{-}(aq)\ \leftrightarrows\ ZnO(s)\ +\ H_{2}O(l)\ +\ 2e^{-}$$
A l'électrode positive, qui joue le rôle de cathode, l'oxyde de manganèse $MnO_{2}$ est réduit en oxohydroxyde de manganèse $MnO(OH$) :
$$MnO_{2}(s)\ +\ H_{2}O(l)\ +\ e^{-}\ \leftrightarrows\ MnO(OH)(s)\ +\ HO^{-}(aq)$$
1.3. Caractéristiques
La tension nominale d'un élément est $1.5V.$
La tension à vide est comprise entre $1.5$ et $1.6V$, la tension en fonctionnement s'étend de $1.15V$ à $1.3V$ et la tension en fin de l'utilisation descend à $0.9V.$
La gamme de température de fonctionnement s'étend de $-30^{\circ}C$ à $50^{\circ}C.$
La durée de stockage peut aller jusqu'à $4$ ans à $20^{\circ}C.$
Les avantages de la pile alcaline à l'oxyde de manganèse par rapport à la pile Leclanché sont les suivants :
$-\ $une énergie massique plus élevée
$-\ $une durée de stockage plus longue
$-\ $la possibilité d'un débit prolongé
$-\ $la résistance interne est plus faible
$-\ $un meilleur comportement aux températures basses
$-\ $une capacité plus performante car elle renferme plus d'oxydant $MnO_{2}$ et de réducteur zinc $Zn$ dans le même volume.
Le seul inconvénient de la pile alcaline à l'oxyde de manganèse par rapport à la pile Leclanché est son prix plus élevé.
Celui-ci est dû à l'utilisation de la poudre zinc à la place du zinc.
1.4. Applications
Les piles alcalines à l'oxyde de manganèse sont adaptées aux applications en service continu car elles permettent un débit important et prolongé.
Elles conviennent pour une consommation de courant de $5\,mL$ à $2A.$
On les rencontre dans les lampes de poches, les appareilles de radio, les lecteurs de $CD$, les alarmes, les eux et les appareilles photos.
2. Pile à oxyde d'argent (pile bouton)

Cette pile possède une $f.e.m$ nominale de $1.55V$
Dans le compartiment on dispose d'une plaque de zinc $Zn$ en contact direct avec un électrolyte $(KOH$ gélifiée$)$ joue le rôle de pont conducteur entre les deux compartiments de la pile.
L'électrode de zinc constitue le pôle négatif
Dans le deuxième compartiment on met une tige en argent $Ag$ en contact direct avec un mélange de $\left(Ag_{2}O^{+}\text{ graphite en poudre}\right)$ l'électrode d'argent constitue le pôle positif.
Les couples redox mis en jeu dans cette pile sont ; $Zn\left(OH\right)_{4}^{2-}/Zn\quad\text{et}\quad Ag_{2}O/Ag$
L'équation de réaction qui se produit dans la pile lorsqu'elle débite un courant électrique est :
$$Zn\ +\ 2OH^{-}\ +\ Ag_{2}O\ +\ H_{2}O\ \longrightarrow\ Zn\left(OH\right)_{4}^{2-}\ +\ 2Ag$$
3. Pile à oxyde de mercure (pile bouton)

La pile possède une $f.e.m$ nominale de $1.35V$
Dans le compartiment on dispose d'une plaque de zinc $Zn$ en contact direct avec un électrolyte $(KOH$ gélifiée$)$ joue le rôle de pont conducteur entre les deux compartiments de la pile.
L'électrode de zinc constitue le pôle négatif.
Dans le deuxième compartiment on a de l'oxyde de mercure $HgO$ et du graphite en poudre imbibées d'hydroxyde de potassium l'électrode de graphite constitue le pôle positif.
Les couples redox mis en jeu dans cette pile sont $Zn\left(OH\right)_{4}^{2-}/Zn\quad\text{et}\quad HgO/Hg$
L'équation de réaction qui se produit dans la pile lorsqu'elle débite un courant électrique est :
$$Zn\ +\ 2OH^{-}\ +\ HgO\ +\ H_{2}O\ \longrightarrow\ Zn\left(OH\right)_{4}^{2-}\ +\ Hg$$

Ajouter un commentaire