Oxydoréduction par voie sèche - 1er s
Classe:
Première
I. Réaction d'oxydoréduction par voie sèche
1. Electronégativité
1.1 Définition
L'électronégativité d'un atome est une grandeur physique qui caractérise sa capacité à attirer les électrons lors de la formation d'une liaison chimique avec un autre élément.
1.2 Indice d'électronégativité
L'indice d'électronégativité, $\epsilon$ ou $E$, est la mesure de la tendance que possède un atome d'un élément à attirer des électrons lorsqu'il se lie avec d'autres atomes.
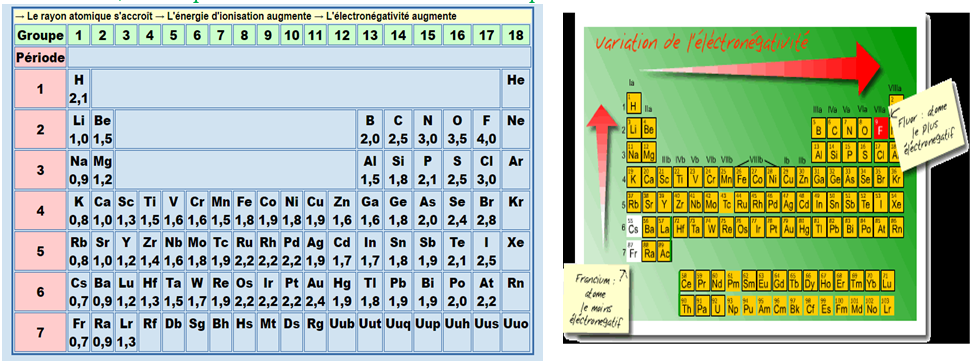
Les valeurs de l'indice d'électronégativité se trouvent dans le tableau périodique.
La valeur la plus petite est $0.7$ et la plus grande $4.$
Dans le tableau périodique, d'une manière générale, l'électronégativité augmente :
$- $ de la gauche vers la droite dans la même période.
$-\ $ du bas vers le haut dans une même colonne.
Ainsi les éléments qui ont beaucoup d'électrons sur leur couche externe, comme les halogènes, ont aussi un indice d'électronégativité élevé, alors que les métaux alcalins ont les indices les plus bas.
1.3 Échelle de Pauling
Sur l'échelle de Pauling, chaque élément a une électronégativité caractéristique allant de $1$ à $4.$
Un élément fortement électronégatif comme le fluor a une électronégativité de 4 tandis que celle des éléments à faible électronégativité comme le lithium est proche de $1.$
Les liaisons entre atomes dont la différence d'électronégativité est grande $($plus grande ou égale à $1.7)$ sont généralement considérées comme ioniques tandis que les valeurs entre $0.4$ et $1.7$ correspondent à des liaisons covalentes polaires et celles inférieures à $0.4$ correspondent à des liaisons covalentes non polaires.
Remarque :
L'électronégativité des gaz nobles est pratiquement nulle.
En effet que les gaz nobles n'ont pas tendance à attirer les électrons des autres atomes car leur dernière couche électronique est complète.
Ils ne se lient à peu près jamais à d'autres atomes.
2. Exemples de réactions d'oxydoréduction par voie sèche
2.1 Réaction du sodium avec le dichlore
2.1.1 Expérience
Sous la hotte aspirante, le sodium $(Na)$ enflammé est introduit dans le bocal de dichlore $(Cl_{2})$, des fumées blanches de chlorure de sodium $(NaCl)$ se forment, puis se déposent sous forme de cristaux blancs

2.1.2 Interprétation
La fumée blanche est du chlorure de sodium $NaCl$ qui résulte de la réaction du sodium avec le dichlore.
L'équation chimique de la réaction observée est :
$$2\,Na(s)\ +\ Cl(g)\ \rightarrow\ 2\,NaCl(s)$$
Le chlorure de sodium est un composé ionique formé par les ions sodium $Na^{+}$ et les ions chlorures $Cl^{-}$ Au cours de cette réaction chaque atome de sodium métal a cédé un électron; le sodium a donc été oxydé selon la demi-équation :
$$Na(s)\ \rightarrow\ Na^{+}\ +\ e^{-}$$
En même temps chaque molécule de dichlore a fixé deux électrons; le dichlore a été réduit selon la demi-équation :
$$Cl(g)\ +\ 2e^{-}\ \rightarrow\ 2Cl^{-}$$
Il y a eu un transfert d'électrons du sodium au dichlore; la réaction étudiée est donc une réaction d'oxydoréduction.
Cette réaction a été réalisée en l'absence d'eau : c'est une réaction d'oxydoréduction par voie sèche.
Remarque :
Historiquement, ce sont des réactions avec l'oxygène qui ont été définies comme des oxydations avant que cette notion ne soit généralisée sous la forme de transfert électronique
2.2 Réaction du carbone avec le dioxygène
2.2.1 Expérience
Chauffons à la flamme d'un bec bunsen un morceau de carbone (par exemple du charbon) jusqu'à l'incandescence et introduisons le dans un flacon contenant du dioxygène.
Le carbone brûle vivement avec une flamme éclairante en produisant des étincelles.
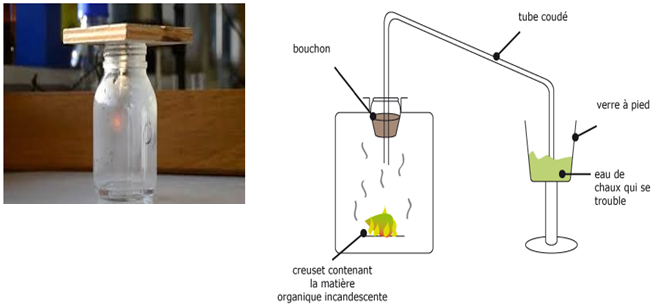
Lorsque la réaction est terminée, ajoutons de l'eau de chaux dans le flacon.
Des particules blanches apparaissent et troublent l'eau de chaux
2.2.2 Interprétation
Le trouble de l'eau de chaux prouve qu'il s'est formé du dioxyde de carbone $CO_{2}.$
L'équation chimique de la réaction observée est :
$$C(s)\ +\ O_{2}(g)\ \rightarrow\ CO_{2}(g)$$
Cette réaction est considérée comme une réaction d'oxydoréduction où le carbone est oxydé et le dioxygène est réduit bien qu'aucun transfert d'électrons ne peut être mis en évidence car le dioxyde de carbone obtenu est un composé à liaisons covalentes.
Pour pouvoir comprendre pourquoi cette transformation est une réaction redox, il est nécessaire d'introduire un nouvel outil : le nombre d'oxydation des éléments.
3. Nombre d'oxydation
3.1 L'état d'oxydation, le nombre d'oxydation
Dans une réaction d'oxydoréduction entre un métal et un non métal, il est facile de « suivre » le transfert d'électrons entre le réducteur et l'oxydant.
Cela est plus difficile lorsque la réaction met en jeu deux non métaux.
Pour « suivre » le transfert d'électrons, les chimistes ont construit un outil commode qui fait appel au nombre ou degré d'oxydation noté $N^{\circ}$
Le nombre l'oxydation ou degré d'oxydation permet de savoir si un élément chimique peut être réduit (il a gagné un ou des électrons) ou oxydé (il a perdu ou gagné un électron) qu'il soit seul ou engagé dans un édifice moléculaire ou ionique.
Le nombre d'oxydation $(NO)$ caractérise l'état d'un élément dans un composé moléculaire ou ionique.
3.1.1 Définition
Le nombre d'oxydation d'un atome dans un édifice polyatomique (molécule ou ion) est la charge électrique qui reste sur cet atome après une coupure fictive de toutes les liaisons.
Remarque :
Les électrons de chaque liaison sont attribués à l'atome le plus électronégatif.
Dans le cas où les atomes sont identiques la coupure de la liaison se fera de manière symétrique
3.1.2 Règles d'attribution
Règle 1
Le nombre d'oxydation d'un élément dans un corps pur simple atomique ou moléculaire est nul
Exemple :
$Cu\ :\ n^{\circ}(Cu)=0\;,\ Cl_{2}\ :\ n^{\circ}(Cl)=0$
Règle 2
Le nombre d'oxydation d'un élément dans un ion monoatomique est égal à la charge de cet ion.
Exemple :
$O^{2-}\ :\ n^{\circ}(O)=\Pi\;,\ Ca^{2+}\ :\ n^{\circ}(Ca)=+\Pi.$
On note en général en lettres romaines les $n^{\circ}.$
Règle 3
La somme de tous les $n^{\circ}$ des éléments dans :
$-\ $ une molécule neutre est égale à $0.$
Exemple :
$H_{2}O\ :\ n^{\circ}(O)+2\,n^{\circ}(H)=0$
$-\ $ un ion est égal à la charge de cet ion.
Exemple :
$NO_{3}^{-}\ :\ n^{\circ}(N)+3\,n^{\circ}(O)=-1$
Règle 4
Dans des composés, les éléments métalliques ont des nombres d'oxydation positifs :
$\bullet $ les éléments du groupe $I$ (alcalins) ont toujours un $n^{\circ}$ de $+I.$
Exemple :
$\bullet $ les éléments du groupe II (alcalino-terreux) ont toujours un n.o de +II.
Exemple :
$NaCl\ :\ n^{\circ}(Na)+n^{\circ}(Cl)=0$ comme $n^{\circ}(Na)=+I\;,\ n^{\circ}(Cl)=-I$
$\bullet $ les éléments du groupe $II$ (alcalino-terreux) ont toujours un $n^{\circ}$ de $+II.$
Exemple :
$CaF_{2}\ :\ n^{\circ}(Ca)+2n^{\circ}(F)=0$ comme $n^{\circ}(Ca)=+II\;,\ n^{\circ}(F)=-II$
Remarques :
Dans des composés, les éléments non métalliques suivants ont les des nombres d'oxydation (n.o) indiqués dans le tableau suivant :
$$\begin{array}{|l|l|l|} \hline \text{Non métal}&\text{Nombre d'oxydation}&\text{Exemple}\\ \hline \text{Fluore}&-I&MgF_{2}\\ \hline \text{Hydrogène}&+I&H_{2}O\\ \hline \text{Oxygène}&-II&CO_{2}\\ \hline \text{Groupe }VII&-I&CCl_{4}\\ \hline \text{Groupe }VI&-II&H_{2}S\\ \hline \text{Groupe }V&-III&NH_{3}\\ \hline \end{array}$$
Il existe cependant des exceptions :
$\bullet $ c'est le cas du peroxyde d'hydrogène $H_{2}O_{2}$, ou « eau oxygénée », comme dans tous les peroxydes, $n^{\circ}(O)=-I$
$\bullet $ L'élément chimique le plus électronégatif, donc le plus oxydant, est le fluor.
Dans la nature, il n'existe que sous sa forme réduite $F^{-}.$
C'est pratiquement le seul élément, avec le chlore, qui puisse oxyder l'élément oxygène
3.2 Utilisation du nombre d'oxydation
L'utilisation du nombre d'oxydation peut nous permettre de reconnaître les réactions d'oxydation et les réactions de réduction qui ont lieu au cours d'une réaction d'oxydoréduction même dans le cas où le transfert d'électron n'est pas évident.
3.2.1 Prévoir la nature d'une réaction chimique
Dans une réaction d'oxydoréduction, il existe un élément qui est oxydé et dont le $n^{\circ}$ augmente et un élément qui est réduit et dont le $n^{\circ}$ diminue.
Exemple :
Réaction entre le métal $Fe$ et les ions $Cu^{2+}$ :
$n^{\circ}(Fe)$ augmente $(0\rightarrow\ +II)$, il subit donc une oxydation $Fe\ +\ Cu^{2+}\ \rightarrow\ Fe^{2+}\ +\ Cu$
$n^{\circ}(Cu)$ diminue $(+II\rightarrow\ 0)$, il subit donc une réduction
Dans une réaction rédox, au moins un des éléments voit son nombre d'oxydation varier
3.2.2 Équilibrer les équations-bilans rédox
Exemple :
$Fe\ +\ Cu^{2+}\ \rightarrow\ Fe^{2+}\ +\ Cu$
$(0)$ $(+II)$
La variation du nombre d'oxydation du $n^{\circ}$ du fer est :
$\Delta\,n^{\circ}(Fe)=+II(>0$ car augmentation$)$
La variation du nombre d'oxydation du $n^{\circ}$ du cuivre :
$\Delta\,n^{\circ}(Cu)=-II(<0$ car diminution$)$
On constate que Ce résultat est général :
Dans une réaction rédox, la somme des variations des $n^{\circ}$ est nulle si on tient compte des coefficients stœchiométriques
Ainsi, pour équilibrer une réaction rédox, si on appelle $\Delta\,n^{\circ}$ la variation du nombre d'oxydation de l'élément qui est oxydé (pour un atome) et $\Delta'\,n^{\circ}$ la variation du nombre d'oxydation pour l'élément qui est réduit (pour un atome), il faut trouver les coefficients $a$ et $b$ tels que $a\Delta\,n^{\circ}+b\Delta'\,n^{\circ}=0$ et les reporter dans l'équation bilan.
Exemple :
Réaction entre le métal $F_{e}$ et les ions hydrogène $H^{+}$ d'une solution d'acide chlorhydrique
$Fe\ +\ 2H^{+}\ \rightarrow\ Fe^{2+}\ +\ H_{2}$
Déterminons la variation du $n^{\circ}$ du fer (pour un atome) :
$\Delta\,n^{\circ}(Fe)=+II-0=+\Pi$
Déterminons la variation du $n^{\circ}$ de l'hydrogène (pour un atome) :
$\Delta'\,n^{\circ}(H)=0-I=-I$
Trouvons les coefficients $a$ et $b$ tels que :
$a\Delta\,n^{\circ}+b\Delta'\,n^{\circ}=0$ et vérifions qu'ils correspondent à l'équation bilan.
$\begin{array}{lcl} a\Delta\,n^{\circ}+b\Delta'\,n^{\circ}&=&0\\ \Rightarrow a(+II)+b(-I)&=&0\\\Rightarrow a&=&1\\\text{ et }b&=&2 \end{array}$
Exercice d'application
Réaction entre le métal cuivre et les ions nitrates $NO_{3}^{-}$ (provenant de l'acide nitrique) en milieu acide.
Cette réaction donne des ions cuivre $(II)$ et du monoxyde d'azote $NO.$
Trouver et équilibrer l'équation-bilan de cette réaction en précisant les espèces qui sont réduites et oxydées.
Indice (quand même !) : il faut assurer la conservation de la charge électrique globale grâce aux ions $H^{+}$ (milieu acide) et la conservation de l'élément oxygène par la formation de molécules d'eau $(H_{2}O$ : solvant
II. Corrosion des métaux
1.Définition
On appelle corrosion l'ensemble des actions chimiques qui détériore les pierres et les métaux.
Remarque :
Les métaux ne résistent pas de la même façon à la corrosion: les métaux nobles sont insensibles ; l'aluminium, le zinc... sont protégés en surface par une mince couche d'oxyde imperméable aux agents extérieurs ; le fer rouille d'abord en surface sous l'action de l'humidité de l'air, jusqu'à la destruction de la pièce
2. Les causes de la corrosion
2.1 Corrosion de type chimique
C'est la réaction entre le métal et une phase gazeuse ou liquide.
Si cette corrosion se produit à haute température elle est alors appelée « corrosion sèche » ou corrosion à haute température.
Au cours de la corrosion chimique, l'oxydation du métal et la réduction de l'oxydant se fait en une seule action, c'est-à-dire les atomes du métal forment directement des liaisons chimiques avec l'oxydant qui arrache les électrons de valence des atomes métalliques.
2.2 Corrosion électrochimique
La corrosion électrochimique, appelée encore corrosion humide, est le mode de corrosion le plus important et le plus fréquent.
Elle réside essentiellement dans l'oxydation du métal sous forme d'ions ou d'oxydes.
La corrosion électrochimique fait appelle à la fois à une réaction chimique et un transfert de charges électriques (circulation d'un courant).
Cette corrosion nécessite la présence d'un agent réducteur $(H_{2}O$, $O_{2}$, $H_{2}$, etc.$)$, sans celui-ci la corrosion du métal ne peut se produire.
La corrosion électrochimique d'un matériau correspond à une réaction d'oxydo-réduction, dont :
$-\ $ la réaction d'oxydation d'un métal est appelée réaction « anodique »,
$-\ $ la réaction de réduction d'un agent oxydant est appelée réaction « cathodique »
III. Applications : protection des métaux, aluminothermie
1. Protection des métaux
Pour s'affranchir de la corrosion, on peut utiliser l'une des solutions suivantes :
1.1 Aciers spéciaux et inoxydables
On ajoute du chrome, du nickel, du titane : Inconvénient : le coût
2.2 Protection par revêtement
$\bullet\ $ On plonge la pièce dans un bain d'acide de façon à réaliser une pellicule imperméable (passivation à l'acide nitrique, parkérisation à l'acide phosphorique pour les carrosseries).
$\bullet\ $ Pour isoler la surface métallique de l'atmosphère oxydante, on recouvre cette dernière d'une peinture, d'un vernis...
$\bullet\ $ On plonge la pièce dans un métal liquide plus réducteur.
Par formation d'une pile électrochimique, le métal se dissout.
On utilise le zinc pour obtenir du fer galvanisé ou de l'étain pour obtenir le fer blanc
3.3 Protection cathodique
Le but consiste à réaliser une pile électrochimique dans lequel l'alliage à protéger joue le rôle de la cathode.
La corrosion se fera donc à l'anode.
$\bullet\ $ Protection de la coque d'un navire en plaçant du zinc
$\bullet\ $ Anode sacrificielle: on réalise une pile électrochimique dans laquelle la cathode est la pièce à protéger et dont l'anode sera sacrifiée (en zinc, en aluminium).
Cette est utilisée pour la protection des canalisations
2. Aluminothermie
L'aluminothermie est un procédé pyrométallurgique consistant à dégager de la chaleur grâce à une réaction chimique de l'aluminium pour produire ou faire fondre des métaux.
La réaction se déroule à haute température $($plus de $2\ 800^{\circ}C).$
2.1 Soudage par aluminothermie
La soudure exothermique regroupe tous les procédés qui utilisent une source de chaleur obtenue par une réaction chimique exothermique créée entre les bords de pièces à souder.
L'exemple le plus représentatif de l'utilisation de ce procédé est le raboutage de rails de chemins de fer.
Exemples de réactions exothermiques réalisées :

A base d'oxydes de fer et d'aluminium :
$3Fe_{3}O_{4}\ +\ 8Al\ \rightarrow\ 9Fe\ +\ 4Al_{2}O_{3}\ +\ 3010\,kJ/mol(3\ 088^{\circ}C)$
A base d'oxydes de cuivre et d'aluminium :
$3Cu_{2}O\ +\ 2Al\ \rightarrow\ 6Cu\ +\ Al_{2}O_{3}\ +\ 1089\,kJ/mol(3\ 138 ^{\circ}C)$
A base de l'oxyde de nickel et d'aluminium :
$3NiO\ +\ 2Al\ \rightarrow\ 3Ni\ +\ Al_{2}O_{3}\ +\ 864\,kJ/mol(3\ 171^{\circ}C)$
A base de l'oxyde de chrome et d'aluminium :
$Cr_{2}O_{3}\ +\ 2Al\ \rightarrow\ 2Cr\ +\ Al_{2}O_{3}\ +\ 2287\,kJ/mol(2\ 977^{\circ}C)$
A base d'oxydes de manganèse et d'aluminium :
$3MnO\ +\ 2A\ \rightarrow\ 3Mn\ +\ Al_{2}O_{3}\ +\ 1686\,kJ/mol(2\ 427^{\circ}C)$

Ajouter un commentaire