Solution des exercices : Les métaux 3e
Classe:
Troisième
Exercice 1
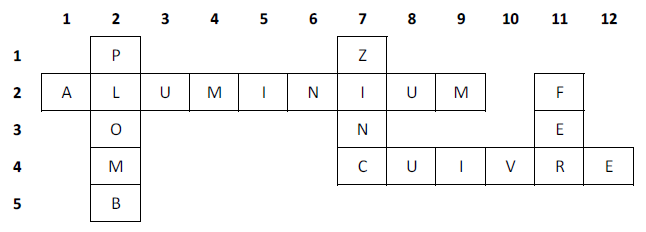
Exercice 2
1) Le bronze est :
un métal : Faux (F)
un alliage : Vrai (V)
un corps métallique : Faux (F)
un non métal : Faux (F)
2) La corrosion d'un métal est :
la perte de son éclat métallique : Vrai (V)
le changement de son état physique : Faux (F)
3) A l'air libre, ce métal sécrète sa propre protection :
le plomb : Vrai (V)
le fer : Faux (F)
le cuivre : Vrai (V)
4) La rouille est :
la couche qui recouvre tout métal : Faux (F)
Le résultat de la corrosion du fer : Vrai (V)
L'oxyde ferrique humide : Vrai (V)
Exercice 3
1) On recouvre le fer de peinture pour le protéger contre la rouille.
2) Le fer blanc est une tôle de fer recouverte d'étain pour protéger de la rouille.
Le fer galvanisé est un fer qui est recouvert d'une fine couche de zinc par galvanisation.
3-1) Quand on expose l'aluminium à l'air libre, il se forme de l'alumine $(Al_{2}O_{3})$
3-2) Quand on expose le zinc à l'air libre, il se forme de l'hydrocarbonate de zinc $(ZnCO_{3}\;;\ H_{2}O)$
3-3) La corrosion de ces deux métaux entraine la formation d'une couche imperméable protectrice.
Par contre, pour celle du fer, on observe sa destruction par la formation de la rouille qui est une couche perméable. Ainsi, l'action de la corrosion se poursuit en profondeur.
Exercice 4
1) Décrivons l'action de l'air sur le zinc :
$-\ $ à froid, le zinc se recouvre d'une couche imperméable qui le protège, appelée hydrocarbonate de zinc $(ZnCO_{3}\;;\ H_{2}O).$
$-\ $ à chaud, l'oxydation du zinc entraine le dégagement d'une fumée blanche qui est constituée d'oxyde de zinc $(ZnO).$
2) Masse d'oxyde de zinc obtenue
Équation de la réaction : $Zn\ +\ \dfrac{1}{2}O_{2}\ \longrightarrow\ ZnO$
On a :
$\begin{array}{rcrcl} n_{Zn}=n_{ZnO}\quad\text{ or, }\ n=\dfrac{m}{M}&\Rightarrow&\dfrac{m_{Zn}}{M_{Zn}}&=&\dfrac{m_{ZnO}}{M_{ZnO}}\\ \\&\Rightarrow&m_{ZnO}&=&\dfrac{m_{Zn}\times M_{ZnO}}{M_{Zn}}\end{array}$
avec $M_{ZnO}=65+16=81\;g/mol$
A.N : $m_{ZnO}=\dfrac{13\times 81}{65}=16.2$
Donc, $\boxed{m_{ZnO}=16.2\;g}$
Exercice 5
1) Masse de fer oxydé
On a : $m_{oxyd}=m\times\dfrac{1}{4}=\dfrac{m}{4}$
A.N : $m_{oxyd}=\dfrac{20}{4}=5$
Donc, $\boxed{m_{oxyd}=5\;g}$
Déduisons la masse d'oxyde ferrique formé.
Équation de la réaction : $2Fe\ +\ \dfrac{3}{2}O_{2}\ \longrightarrow\ Fe_{2}O_{3}$
On a :
$\begin{array}{rcrcl}\dfrac{n_{Fe}}{2}=\dfrac{n_{Fe_{2}O_{3}}}{1}&\Rightarrow&n_{Fe}&=&2n_{Fe_{2}O_{3}}\quad\text{ or, }\ n=\dfrac{m}{M}\\ \\ &\Rightarrow&\dfrac{m_{Fe}}{M_{Fe}}&=&2\times\dfrac{m_{Fe_{2}O_{3}}}{M_{Fe_{2}O_{3}}}\\ \\ &\Rightarrow&m_{Fe_{2}O_{3}}&=&\dfrac{m_{Fe}\times M_{Fe_{2}O_{3}}}{2\times M_{Fe}}\end{array}$
avec $M_{Fe_{2}O_{3}}=2\times 56+3\times 16=160\;g/mol$
A.N : $m_{Fe_{2}O_{3}}=\dfrac{5\times 160}{2\times 56}=7.143$
Donc, $\boxed{m_{Fe_{2}O_{3}}=7.143\;g}$
2) La masse d'eau contenue dans la rouille formée.
On a $Fe_{2}O_{3}\;;\ 5H_{2}O$, traduction mathématique :
$1\;mol\ (Fe_{2}O_{3})\ \longrightarrow\ 5\;mol\ (H_{2}O)$
$x\;mol\ (Fe_{2}O_{3})\ \longrightarrow\ n\;mol\ (H_{2}O)$
Donc,
$\begin{array}{rcrcl} n\;mol=5\times x\;mol&\Rightarrow&\dfrac{m_{H_{2}O}}{M_{H_{2}O}}&=&5\times\dfrac{m_{Fe_{2}O_{3}}}{M_{Fe_{2}O_{3}}}\\ \\ &\Rightarrow&m_{H_{2}O}&=&\dfrac{5\times m_{Fe_{2}O_{3}}\times M_{H_{2}O}}{M_{Fe_{2}O_{3}}}\end{array}$
avec $M_{H_{2}O}=18\;g/mol$
A.N : $m_{H_{2}O}=\dfrac{5\times 7.143\times 18}{160}=4.018$
Donc, $\boxed{m_{H_{2}O}=4.018\;g}$
3) La masse de rouille formée
$m_{r}=m_{Fe_{2}O_{3}}+m_{H_{2}O}$
A.N : $m_{r}=7.143+4.018=11.161$
Donc, $\boxed{m_{r}=11.161\;g}$
4) La masse du morceau de fer rouillé avant son nettoyage.
On a : $m_{total}=m_{non\;r}+m_{r}\ $ avec, $\ m_{non\;r}=\dfrac{3}{4}\times m$
A.N : $m_{total}=\dfrac{3\times 20}{4}+11.161=26.161$
Donc, $\boxed{m_{total}=26.161\;g}$
Exercice 6
1) L'équation bilan de la réaction est de la forme : $$3PbO\ +\ \dfrac{1}{2}O_{2}\ \longrightarrow\ Pb_{3}O_{4}$$
2) Calculons la masse molaire du minium.
On a :
$\begin{array}{rcl} M_{Pb_{3}O_{4}}&=&3M_{Pb}+4M_{O} \\ &=&3\times 207+4\times 16 \\ &=&685\end{array}$
Donc, $\boxed{M_{Pb_{3}O_{4}}=685\;g.mol^{-1}}$
3) Calculons le volume de $O_{2}$ obtenu.
D'après l'équation bilan on a :
$\begin{array}{rcrcl}\dfrac{n_{O_{2}}}{\tfrac{1}{2}}=\dfrac{n_{Pb_{3}O_{4}}}{1}&\Rightarrow&2n_{O_{2}}&=&n_{Pb_{3}O_{3}}\quad\text{ or, }\ n=\dfrac{m}{M}=\dfrac{V}{V_{M}}\\ \\&\Rightarrow&2\times\dfrac{V_{O_{2}}}{V_{M}}&=&\dfrac{m_{Pb_{3}O_{4}}}{M_{Pb_{3}O_{4}}}\quad\text{ avec, }\ V_{M}=\text{volume molaire}\\ \\&\Rightarrow&2V_{O_{2}}&=&\dfrac{m_{Pb_{3}O_{4}}\times V_{M}}{M_{Pb_{3}O_{4}}}\\ \\&\Rightarrow&V_{O_{2}}&=&\dfrac{m_{Pb_{3}O_{4}}\times V_{M}}{2\times M_{Pb_{3}O_{4}}}\end{array}$
A.N : $V_{O_{2}}=\dfrac{13.07\;10^{3}\times 22.4}{2\times 685}=224$
Donc $\boxed{V_{O_{2}}=224\;l}$
Exercice 7
1) En brûlant le cuivre dans l'air, on obtient l'oxyde cuivrique $CuO$ et l'oxyde cuivreux $Cu_{2}O.$
Écrivons les équations bilan respectives de leurs formations.
$-\ $ formation de $CuO\ :\ Cu\ +\ \dfrac{1}{2}O_{2}\ \longrightarrow\ CuO$
$-\ $ formation de $Cu_{2}O\ :\ 2Cu\ +\ \dfrac{1}{2}O_{2}\ \longrightarrow\ Cu_{2}O$
2) Calculons le volume de dioxygène nécessaire.
D'après l'équation bilan on a :
$\begin{array}{rcrcl}\dfrac{n_{O_{2}}}{\tfrac{1}{2}}=\dfrac{n_{Cu_{2}O}}{1}&\Rightarrow&2n_{O_{2}}&=&n_{Cu_{2}O}\quad\text{ or, }\ n=\dfrac{m}{M}=\dfrac{V}{V_{M}}\\ \\&\Rightarrow&2\times\dfrac{V_{O_{2}}}{V_{M}}&=&\dfrac{m_{Cu_{2}O}}{M_{Cu_{2}O}}\quad\text{ avec, }\ V_{M}=\text{volume molaire}\\ \\&\Rightarrow&2V_{O_{2}}&=&\dfrac{m_{Pb_{3}O_{4}}\times V_{M}}{M_{Pb_{3}O_{4}}}\\ \\&\Rightarrow&V_{O_{2}}&=&\dfrac{m_{Cu_{2}O}\times V_{M}}{2\times M_{Cu_{2}O}}\end{array}$
avec $M_{Cu_{2}O}=2M_{Cu}+M_{O}=2\times 64+16=144\ \Rightarrow\ M_{Cu_{2}O}=144\;g.mol^{-1}$
A.N : $V_{O_{2}}=\dfrac{7.2\times 22.4}{2\times 144}=0.56$
Donc $\boxed{V_{O_{2}}=0.56\;l}$
3) Calculons la masse de cuivre oxydé.
D'après l'équation bilan on a :
$\begin{array}{rcrcl}\dfrac{n_{Cu}}{2}=\dfrac{n_{Cu_{2}O}}{1}&\Rightarrow&n_{Cu}&=&2n_{Cu_{2}O}\quad\text{ or, }\ n=\dfrac{m}{M}\\ \\&\Rightarrow&\dfrac{m_{Cu}}{M_{Cu}}&=&2\times\dfrac{m_{Cu_{2}O}}{M_{Cu_{2}O}}\\ \\&\Rightarrow&m_{Cu}&=&\dfrac{2\times m_{Cu_{2}O}\times M_{Cu}}{M_{Cu_{2}O}}\end{array}$
A.N : $m_{Cu}=\dfrac{2\times 7.2\times 64}{144}=6.4$
Donc $\boxed{m_{Cu}=6.4\;g}$
Activité
1) Complétons le tableau :
$$\begin{array}{|c|c|c|c|c|c|}\hline \text{Métal}&\text{Al}&\text{Zn}&\text{Fe}&\text{Pb}&\text{Cu}\\ \hline \text{Couleur}&\text{blanche}&\text{blanchâtre}&\text{grise}&\text{blanchâtre}&\text{rouge}\\ \hline&\text{se recouvre}&\text{il se forme}&\text{se revouvre}&\text{il se forme }&\text{se forme}\\&\text{d'une couche}&\text{une couche}&\text{d'une couche}&\text{une couche}&\text{une couche}\\&\text{superficielle,}&\text{imperméable}&\text{poreuse}&\text{imperméable :}&\text{imperméable}\\ \text{Comportement}&\text{imperméable}&\text{appelée}&\text{de couleur}&\text{hydro-}&\text{appelée}\\ \text{à l'air humide}&\text{et protectrice}&\text{hydro-}&\text{brune :}&\text{carbonate}&\text{vert-de-gris}\\&\text{qui vernit}&\text{carbonate}&\text{la rouille}&\text{de Plomb}&\\&\text{son éclat}&\text{de zinc}&&&\\&\text{métallique :}&&&&\\&\text{c'est l'alumine}&&&&\\ \hline \text{Utilisation}&\text{emballages}&\text{toitures}&\text{rails}&\text{canalisations}&\text{fils}\\ \text{usuelle}&&&&&\text{électriques}\\\hline \end{array}$$
2) Description d'une expérience qui permet de distinguer une lame de fer et une lame de cuivre :
Laissons à l'air libre ces deux lames de métaux.
Alors, par l'action de l'oxygène de l'air, nous constatons que ceux-ci se recouvrent, chacun, d'une couche :
Le fer se recouvre d'une couche poreuse de couleur brune ; la rouille. Tandis que le cuivre se recouvre d'une couche imperméable ; vert-de-gris ou hydrocarbonate de cuivre.
Exercice 8
A chaud, le dioxygène réagit avec le fer pour donner de l'oxyde magnétique de fer $\left(Fe_{3}O_{4}\right).$
Dans les mêmes conditions, le dioxygène réagit avec l'aluminium pour donner de l'oxyde d'aluminium ou alumine $\left(Al_{2}O_{3}\right).$
Écrivons l'équation-bilan de chaque réaction :
$-\ $ Pour le fer :
$$3Fe\ +\ 2O_{2}\ \longrightarrow\ Fe_{3}O_{4}$$
$-\ $ Pour l'aluminium :
$$4Al\ +\ 3O_{2}\ \longrightarrow\ 2Al_{2}O_{3}$$
Exercice 9
Équilibrons les équations suivantes :
$$Zn\ +\ 2H^{+}\ \longrightarrow H_{2}\ +\ Zn^{2+}$$
$$2Al\ +\ 6H^{+}\ \longrightarrow\ 3H_{2}\ +\ 2Al^{3+}$$
$$Fe\ +\ 2H^{+}\ \longrightarrow\ H_{2}\ +\ Fe^{2+}$$
Exercice 10
1) Dans un tube à essais contenant de la grenaille de zinc, on introduit une solution diluée d'acide chlorhydrique.
a) On sait que le zinc réagit avec l'acide chlorhydrique en donnant du chlorure de zinc et du dihydrogène.
Donc, le gaz produit lors de la réaction est du dihydrogène : $H_{2}$
b) Pour mettre en évidence ce gaz, on approche une flamme à l'ouverture de ce tube, cela provoque alors une détonation. Ce qui est caractéristique de la présence du dihydrogène.
c) L'équation globale de la réaction qui se produit est donnée par :
$$Zn\ +\ 2HCl\ \longrightarrow\ ZnCl_{2}\ +\ H_{2}$$
2) On introduit maintenant la solution diluée d'acide chlorhydrique dans des tubes à essais contenant successivement de la limaille de fer, de la poudre d'aluminium, de la tournure de cuivre et du plomb.
a) On sait que l'acide chlorhydrique $(HCl)$ ne réagit pas avec le cuivre et que sa réaction avec le Plomb $(Pb)$ est éphémère.
Cependant, le fer $(Fe)$ et l'aluminium $(Al)$ réagissent parfaitement avec l'acide chlorhydrique.
Donc, on observe une réaction dans les tubes à essais contenant successivement de la limaille de fer, de la poudre d'aluminium.
b) Écrivons l'équation ionique des réactions qui se produisent.
$$Al\ +\ 3(H^{+}+Cl^{-}) \longrightarrow\ (Al^{3+}+3Cl^{-})\ +\ \dfrac{3}{2}H_{2}$$
$$Fe\ +\ 2(H^{+}+Cl^{-}) \longrightarrow\ (Fe^{2+}+2Cl^{-})\ +\ H_{2}$$
Exercice 11
Expliquons pourquoi on utilise le zinc et non le fer pour couvrir les toits des maisons.
En effet, laissé à l'air libre, le zinc, par l'action de l'oxygène, se recouvre d'une couche imperméable appelée hydrocarbonate de zinc $(ZnCO_{3}\;;\ H_{2}O)$ qui protège le métal contre la corrosion. Tandis que le fer, à l'air libre, se recouvre d'une couche poreuse appelée la rouille $(Fe_{2}O_{3}\;;\ H_{2}O).$
Ainsi, le fer étant plus sensible aux effets corrosifs de la nature, il est préférable de couvrir les toits des maisons avec le zinc.
Exercice 12
On veut conserver de l'acide sulfurique dilué dans trois pots respectivement en fer, en cuivre et en zinc.
1) La conservation est impossible avec les pots en fer et en zinc.
En effet, l'acide sulfurique réagit avec le fer et le zinc en donnant d'autres produits.
Cependant, il ne réagit pas avec le cuivre.
Par conséquent, les pots en fer et en zinc ne pourront être utilisés pour la conservation de l'acide sulfurique dilué car celui-ci déclenchera une réaction qui donnera d'autres produits.
2) Les équations bilans ioniques globales des réactions chimiques qui se produisent avec les métaux des pots inutilisables (pot en fer et en zinc) sont données par :
$\centerdot\ $ fer : $\ Fe^{2+}\ +\ (2H^{+}+SO_{4}^{2-})\ \longrightarrow\ (Fe^{2+}+SO_{4}^{2-})\ +\ H_{2}$
$\centerdot\ $ zinc : $\ Zn^{2+}\ +\ (2H^{+}+SO_{4}^{2-})\ \longrightarrow\ (Zn^{2+}+SO_{4}^{2-})\ +\ H_{2}$
Exercice 13
Ibrahima dispose de $3$ lames fraichement décapées de fer, de cuivre et de zinc.
1) Déterminons l'aspect physique de chacune de ces métaux :
$\centerdot\ $ Fer : aspect Gris ;
$\centerdot\ $ Cuivre : aspect Rouge ;
$\centerdot\ $ Zinc : aspect Blanchâtre.
2) On expose les trois lames à l'air libre. Donnons les réactions susceptibles de se produire :
$$4Fe\ +\ 3O_{2}\ \longrightarrow\ 2Fe_{2}O_{3}$$
$$2Cu\ +\ O_{2}\ \longrightarrow\ 2CuO$$
$$2Zn\ +\ O_{2}\ \longrightarrow\ 2ZnO$$
Les produits qui se forment sont :
$\centerdot\ Fe_{2}O_{3}\ $ = oxyde ferrique ;
$\centerdot\ CuO\ $ = oxyde de cuivrique;
$\centerdot\ ZnO\ $ = oxyde de zinc.
3) Pour chaque métal, écrivons le(s) équation(s)-bilan(s) des réactions lors de l'oxydation à chaud :
Le Fer : $3Fe\ +\ 2O_{2}\ \longrightarrow\ Fe_{3}O_{4}$ ;
Le cuivre : $4Cu\ +\ O_{2}\ \longrightarrow\ 2Cu_{2}O\ $ ; $\ 2Cu_{2}O\ +\ O_{2}\ \longrightarrow\ 4CuO$
Le Zinc : $2Zn\ +\ O_{2}\ \longrightarrow\ 2ZnO$
Exercice 14
Fatou fait réagir complètement $3.25\;g$ de zinc avec une solution décimolaire d'acide chlorhydrique.
1) Écrivons l'équation-bilan de la réaction.
Comme le zinc réagit avec de l'acide chlorhydrique en donnant du chlorure de zinc et du dihydrogène alors, l'équation de la réaction est donnée par :
$$Zn\ +\ HCl\ \longrightarrow\ ZnCl_{2}\ +\ H_{2}$$
En équilibrant cette équation, on obtient l'équation-bilan de la réaction suivante :
$$Zn\ +\ 2HCl\ \longrightarrow\ ZnCl_{2}\ +\ H_{2}$$
Ou encore, sous forme ionique :
$$Zn\ +\ 2(H^{+}+Cl^{-})\ \longrightarrow\ (Zn^{2+}+2Cl^{-})\ +\ H_{2}$$
2) Déterminons le volume $V$ de la solution d'acide utilisé.
D'après l'équation bilan, on a :
$$\dfrac{n_{_{Zn}}}{1}=\dfrac{n_{_{HCl}}}{2}$$
Donc, $n_{_{HCl}}=2\times n_{_{Zn}}\ $ or, $\ n_{_{Zn}}=\dfrac{m_{_{Zn}}}{M_{_{Zn}}}$
Par suite, $n_{_{HCl}}=2\times\dfrac{m_{_{Zn}}}{M_{_{Zn}}}$
A.N : $n_{_{HCl}}=2\times\dfrac{3.25}{65}=0.1\;mol$
D'après l'énoncé, Fatou a utilisé pour cette expérience une solution décimolaire d'acide chlorhydrique.
Ce qui correspond à une concentration $c=10^{-1}\;mol.L^{-1}$
Or, $\ c=\dfrac{n_{_{HCl}}}{V}\ $ donc, $V=\dfrac{n_{_{HCl}}}{c}$
A.N : $V=\dfrac{0.1}{0.1}=1$
D'où, $\boxed{V=1\;L}$
Déterminons le volume de dihydrogène obtenu
D'après l'équation bilan, on a :
$$\dfrac{n_{_{Zn}}}{1}=\dfrac{n_{_{H_{2}}}}{1}$$
Donc, $n_{_{Zn}}=n_{_{H_{2}}}\ $ or, $\ n_{_{Zn}}=\dfrac{m_{_{Zn}}}{M_{_{Zn}}}\ $ et $\ n_{_{H_{2}}}=\dfrac{V_{_{H_{2}}}}{V_{_{M}}}$
Par suite, $\dfrac{V_{_{H_{2}}}}{V_{_{M}}}=\dfrac{m_{_{Zn}}}{M_{_{Zn}}}$
Ce qui donne : $V_{_{H_{2}}}=\dfrac{m_{_{Zn}}\times V_{_{M}}}{M_{_{Zn}}}$
A.N : $V_{_{H_{2}}}=\dfrac{3.25\times 24}{65}=1.2$
D'où, $\boxed{V_{_{H_{2}}}=1.2\;L}$

Commentaires
Papa alassane sow (non vérifié)
dim, 05/12/2019 - 19:53
Permalien
Cours et exercice corrigé sur les metaux
pape (non vérifié)
ven, 03/20/2020 - 12:39
Permalien
math
ABAKAR ABDOULAY... (non vérifié)
ven, 01/12/2024 - 19:15
Permalien
Je veux absolument les
ABAKAR ABDOULAY... (non vérifié)
ven, 01/12/2024 - 19:15
Permalien
Je veux absolument les
Dado (non vérifié)
lun, 02/17/2020 - 10:16
Permalien
Tout les solutions de 1 à 13
Ibrahima Sidibé (non vérifié)
mar, 06/29/2021 - 21:49
Permalien
Dg
Ibrahima Sidibé (non vérifié)
mar, 06/29/2021 - 21:49
Permalien
Dg
Camara Sekou (non vérifié)
mar, 02/25/2020 - 00:24
Permalien
Apprenant
Anonyme (non vérifié)
jeu, 02/27/2020 - 23:32
Permalien
Bjour je voulais la
mlvn (non vérifié)
mar, 04/21/2020 - 12:13
Permalien
Correction de l'exercice supp
LEO (non vérifié)
mar, 04/28/2020 - 13:05
Permalien
REPONSE
BABACAR DIEYE (non vérifié)
mar, 07/14/2020 - 15:36
Permalien
SALUT
Rokhaya niang (non vérifié)
dim, 07/26/2020 - 18:29
Permalien
Faire réussir les sciences physique
Conde (non vérifié)
mer, 03/24/2021 - 14:49
Permalien
Guide de cours
Anonyme (non vérifié)
mar, 04/20/2021 - 01:18
Permalien
C'est très bien car ça nous
Anonyme (non vérifié)
mar, 04/20/2021 - 01:18
Permalien
C'est très bien car ça nous
Seck (non vérifié)
mar, 04/20/2021 - 01:16
Permalien
Intéressant
Anonyme (non vérifié)
dim, 07/25/2021 - 07:24
Permalien
Merci
Sona (non vérifié)
dim, 07/25/2021 - 07:25
Permalien
Pdf
Anonyme (non vérifié)
ven, 05/27/2022 - 00:31
Permalien
Il y’a une erreur au niveau
mespoirromain@g... (non vérifié)
dim, 06/05/2022 - 12:47
Permalien
Je veux avoir la série des
mespoirromain@g... (non vérifié)
dim, 06/05/2022 - 12:47
Permalien
Je veux avoir la série des
Aïssata Dia (non vérifié)
mer, 03/06/2024 - 01:16
Permalien
Merci
Ajouter un commentaire