Les savons - TL
Classe:
Terminale
I. Acides gras
1. Définition
Les acides gras sont des acides à chaines linéaires saturées ou non possédant un nombre d'atomes de carbone $n$ pair et tel que $4\leq n\leq 22$
2. Exemples d'acides gras
$-\ $l'acide linoléique
$CH_{3}-\left(CH_{2}\right)_{4}-CH=CH-CH_{2}-CH=CH-\left(CH_{2}\right)_{7}-COOH$
$-\ $l'acide oléique
$CH_{3}-\left(CH_{2}\right)_{7}-CH=CH-\left(CH_{2}\right)_{7}-COOH$
$-\ $l'acide palmitique
$CH_{3}-\left(CH_{2}\right)_{14}-COOH$
II. Polyalcools : $\text{propane}-1\;,\ 2\;,\ 3-\text{triol}$
1. Définition
Un polyalcool ou un polyol est un composé chimique organique qui possède plusieurs fonctions alcool.
Remarque
Le glycérol ou la glycérine $\left(C_{3}H_{8}O_{3}\right)$ est un polyol.
Son nom officiel est le $\text{propan}-1\;,\ 2\;,\ 3-\text{triol}$ $(\text{ou }1\;,\ 2\;,\ 3-\text{propanetriol}).$
C'est un triol, il possède trois fonctions alcool.
Il a pour formule semi-développée :
2. Nomenclature de polyalcools ou polyols
On fait précéder le suffixe du préfixe multiplicatif adéquat (di, tri, tétra, penta...) précédé des numéros des atomes de carbone portant les groupes d'hydroxydes séparés par des virgules, l'ensemble étant mis entre tirets.
Exemples :
$CH_{2}OH-CH_{2}OH$ : $\text{éthane}-1\;,\ 2-\text{diol}$
$CH_{2}OH-CHOH-CH_{2}OH$ : $\text{propane}-1\;,\ 2\;,\ 3-\text{triol ou glycérol}$
$CH_{3}-CHOH\left(CH_{3}\right)$ : $2\;,\ 3-\text{diméthylbutane}-2\;,\ 3-\text{diol}$
III. Estérification
1. Les corps gras
1.1. Définition
Les corps gras sont des polyesters plus précisément des triesters du glycérol
1.2. Classification
Il existe trois familles de corps gras :
$-\ $Les matières grasses d'origine animale (beurre, gras de bœuf, saindoux, graisse de bœuf...)
$-\ $Les matières grasses d'origine végétale (huiles pour assaisonnement, fritures et margarines végétales, olives, colza...
$-\ $Les matières grasses mixtes : assemblage de graisses en deux parties $($margarine avec graisse d'origine végétale$+$graisse de poisson$)$
Remarque :
Ils sont insolubles dans l'eau donc hydrophobes, possèdent une densité $<1$ et un toucher onctueux.
1.3. Estérification des acides gras
Les acides gras réagissent avec le $\text{propane}-1\;,\ 2\;,\ 3-\text{triol (ou glycérol)}$ pour le triester du glycérol (ou glycéride) appelé corps gras et de l'eau.
L'équation-bilan de la réaction s'écrit :
3. Applications des esters
Les esters ont souvent une odeur agréable et sont souvent à l'origine de l'arôme naturel des fruits.
Ils sont aussi beaucoup utilisés pour les arômes synthétiques (industrie agroalimentaire) et dans la parfumerie.
Les esters sont aussi un constituant de base dans l'industrie des plastiques.
Ils sont à la base d'un des plastiques les plus utilisés, le polyester (fibres textiles, vêtements, emballages, bouteilles en PET....).
L'estérification est utile, de par son caractère réversible (pour les acides carboxyliques et les alcools, tout du moins), dans le cadre de la protection de fonctions.
Puisque la transformation est réversible, elle permet de protéger soit la fonction alcool, soit la fonction acide carboxylique, soit les deux.
En effet, si on veut protéger un alcool, on le fait réagir avec un acide carboxylique pour former un ester ; on fait la réaction que l'on voulait effectuer ; une fois celle-ci finie, on renverse la réaction d'estérification pour retrouver l'alcool.
IV. Saponification
1. Définition
La saponification est, dans le cadre général, une réaction chimique transformant un ester en ion carboxylate et en alcool.
Il s'agit en fait de l'hydrolyse d'un ester en milieu basique. Cette réaction permet la synthèse du savon.
2. Équation de la réaction de saponification
La réaction donne un alcoolate et un carboxylate de potassium ou de sodium.
L'équation-bilan de la réaction s'écrit :
$\begin{array}{llll} R-CO-O-R'+MOH&\longrightarrow&R-COO^{-}M^{+}+&R'-OH\\ \left(M=Na^{+}\;,\ K^{+}\right)&&\text{Carboxylate de }M&\text{Alcol}\\ &&\text{(Savon)}& \end{array}$
La saponification conduit à la formation du savon lorsqu'elle est effectuée avec des esters particuliers.
La saponification d'un triglycéride (corps gras) par l'hydroxyde de sodium par exemple donne le glycérol et un carboxylate de sodium
Remarques
$-\ $selon la nature de base forte utilisée, on obtient des savons aux propriétés différentes.
Exemple :
$$\begin{array}{|l|c|c|} \hline \text{sel alcalin}&M^{+}&\text{propriétés}\\ \hline \text{carboxylate de sodium}&Na^{+}&\text{savon dur}\\ \text{carboxylate de potassium}&K^{+}&\text{savon mou}\\ \hline \end{array}$$
$-\ $Les savons contiennent aussi de l'eau et des additifs variés.
$-\ $Sous sa forme la plus simple, le savon est un produit détergent totalement biodégradable.
Les additifs peuvent être polluants pour l'environnement.
3. Caractéristiques de la réaction de saponification
La saponification est une réaction lente mais totale.
Elle dégage également une importante quantité de chaleur : elle est fortement exothermique.
4. Mode d'action d'un savon
4.1. La détergence
Un détergent (ou agent de surface, détersif, tensioactif, surfactant) est un composé chimique, doté de propriétés tensioactives, ce qui le rend capable d'enlever les salissures.
La détergence est un élément d'hygiène fondamental, puisqu'il permet d'éliminer une grande partie des salissures et bactéries présentes sur le linge (lessive), la peau (savon), les objets du quotidien d'une maison (produits ménagers...).
On distingue :
$-\ $les détergents anioniques (alkylsulfates, alkylsulfonates, alkylcarboxylates) principalement utilisés dans les savons, les lessives et les produits de nettoyage,
$-\ $les détergents cationiques (chlorhydrates d'amine, ammoniums quaternaires) principalement utilisés dans les milieux industriels et hospitaliers, en raison de leur propriété désinfectante,
$-\ $les détergents ampholytes, s'ionisant négativement (anions) ou positivement (cations), selon les conditions du milieu,
$-\ $es détergents non-ioniques (hydroxyles), utilisés dans l'industrie textile, la métallurgie et en cosmétologie (hygiène corporelle et beauté) en raison d'une moindre agressivité et d'un faible pouvoir moussant.
4.2. Propriétés de l'ion carboxylate
L'action détergente d'un savon est liée à la quantité d'ions carboxylate dissouts dans l'eau savonneuse.
Plus cette quantité est importante, plus le savon « mousse » et mieux il lave.
L'ion carboxylate est un détergent anionique.
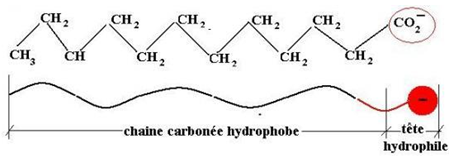
L'ion carboxylate, appelé parfois (à tort) « molécule de savon » est un édifice dite amphiphile c'est-à-dire composé :
$-\ $d'une chaîne $($ou queue $R)$ hydrocarbonée non polaire, donc hydrophobeet lipophile (soluble dans les lipides)
$-\ $d'une tête carboxylate $(-COO-)$ polaire donc lipophobe et hydrophile (soluble dans l'eau).
C'est la tête qui assure la solubilité du savon dans l'eau par des liaisons hydrogène.


4.3. Les tensioactifs et l'eau
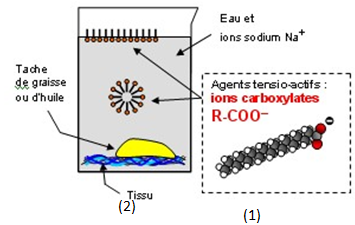
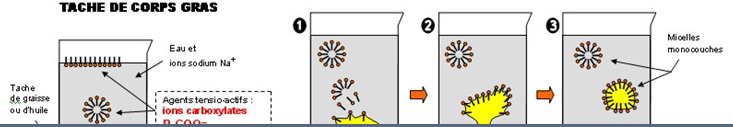
Dans l'eau, les molécules tensioactives de savons ne restent pas dispersées mais se rassemblent :
$-\○ $tout d'abord à l'interface air / eau (1), la tête hydrophile dans l'eau et la queue hydrophobe dans l'air,
$-\ $puis, lorsque toute la surface est occupée, entre elles pour former des micelles où toutes les queues hydrophobes se rassemblent au centre (2)
Remarque
Si de l'air barbote dans de l'eau, les bulles formées au sein du liquide crèvent en arrivant à la surface mais si l'eau contient un agent tensioactif, les bulles sont stables et s'amassent pour former une mousse.
C'est pour cela que « plus le savon mousse mieux il lave ».
4.4. Principe de la détergence


Ajouter un commentaire